|
|
|
CAMERA DEI DEPUTATI
|
N. 5442 |
Pag. 1
Alla fine di quel convegno, consci che il problema non poteva essere risolto davanti a una platea e animati da una sincera volontà di ricercare una soluzione più congrua e in linea con i tempi e con il sentire della società civile, ci ritrovammo intorno ad un tavolo a studiare una strategia comune.
Da quel giorno vennero organizzati alla Camera dei deputati numerosi incontri di lavoro fino al mese di novembre 2004. Le idee si sono pian piano modellate in proposte concrete e alla fine hanno preso la forma di una proposta di legge.
Abbiamo chiamato questo tavolo di riunione «Comitato per la revisione del decreto legislativo n. 116 del 1992 in materia di protezione degli animali utilizzati a fini sperimentali o ad altri fini scientifici». Il Comitato si è riunito per ben 23 giornate per un totale di 136 ore di lavoro dalle quali è nato il testo che oggi si ha l'onore di presentare.
Non si tratta di una proposta di legge creata sull'onda dell'emotività come spesso accade quando si affrontano tematiche che, come questa, mettono a dura prova la coscienza di tutti. È una proposta di legge che nasce dal «dialogo» tra coloro che
Pag. 2
Attorno al tavolo di lavoro si sono seduti i migliori esperti del settore in rappresentanza dell'industria farmaceutica nazionale e multinazionale, delle università, delle associazioni di varie categorie, degli istituti di ricerca, delle organizzazioni animaliste. E precisamente: la Farmindustria; l'Associazione italiana per le scienze degli animali da laboratorio, l'Associazione italiana di psicologia; la sezione italiana dell'European Biomedical Research Association; le società italiane di farmacologia, tossicologia, fisiologia, neuroscienze, anatomia; l'Associazione delle industrie della salute animale; l'Associazione nazionale medici veterinari italiani; l'Ordine nazionale dei biologi; l'Associazione italiana tossicologia in vitro; la Lega anti vivisezione, l'Eurogroup for Animal Welfare, il «Progetto riabilitazione animali da laboratorio»; figure istituzionali, quali il Ministero della salute e l'Istituto superiore di sanità.
Non ci siamo posti l'obiettivo di dare una risposta a degli interrogativi che animano il dibattito sulla sperimentazione animale: se sia scientificamente valido utilizzare gli animali nella ricerca, se i dati ottenuti sugli animali siano trasferibili all'uomo, se sia arrivato il momento di porre fine all'utilizzo di animali per fini scientifici. Pur non rinunciando ai propri convincimenti, ciascuno ha accettato di impegnarsi su un obiettivo comune: riscrivere l'attuale normativa che tutela gli animali utilizzati a scopi di ricerca, migliorare quanto più possibile le condizioni degli animali, dall'allevamento all'arrivo nello stabilimento utilizzatore dove viene effettuato il progetto di ricerca, dal complesso delle procedure a cui gli animali vengono sottoposti al loro possibile reinserimento.
Sebbene, nella prima fase dei lavori, non siano mancati aspri confronti su questi punti, abbiamo preso atto che non è possibile, allo stato attuale, prescindere da un contesto mondiale, nel quale l'utilizzo degli animali a scopo di ricerca non è considerato una «eccezione» ma una «regola», in molti casi obbligatoriamente richiesta da normative internazionali per lo studio e per la commercializzazione di qualsiasi prodotto, farmaceutico e non, destinato all'uso umano e animale.
L'Italia, anche se volesse, non è in grado né di modificare, né di contrastare questo scenario di regole. La presente proposta di legge si pone quindi come un contributo innovativo e propositivo anche nei confronti dei nostri partner europei al fine di sollecitare una più ampia riflessione su una normativa, la direttiva 86/609/CEE del Consiglio, del 24 novembre 1986, considerata non più attuale e adeguata al progresso scientifico e alla formazione di una nuova sensibilità maturata negli ultimi anni dall'opinione pubblica. Una riforma, la nostra, in grado di essere un punto di riferimento avanzato per i lavori in corso a livello europeo finalizzati alla revisione della citata direttiva sulla sperimentazione animale.
Illustriamo ora i punti qualificanti della proposta di legge.
Metodi alternativi.
I metodi alternativi rappresentano la concreta speranza per il futuro di non utilizzare gli animali nella ricerca, almeno per ciò che riguarda la ricerca applicata.
L'«alternativa» si fonda sul «sistema delle 3R»: Replacement, Reduction, Refinement (sostituzione, riduzione, perfezionamento). È un percorso che coniuga l'interesse economico a ridurre i costi della ricerca con quello più specificatamente etico di evitare il sacrificio degli animali in nome del progresso scientifico.
In tutto il mondo si guarda con attenzione e speranza allo sviluppo di questi nuovi metodi di ricerca.
Una forte accelerazione è stata impressa recentemente dalla nuova direzione dell'European Centre for the Validation of Alternative Methods (ECVAM), istituto tecnico della Commissione europea con il compito di studiare, promuovere e «validare» i procedimenti in cui non si fa impiego di animali.
In ogni Paese membro dell'Unione europea (tra cui anche l'Italia) hanno preso corpo valide iniziative come l'European
Pag. 3
L'Europa, inoltre, ha varato il Sesto programma quadro di ricerca e sviluppo, che beneficia di un finanziamento comunitario per progetti di ricerca diretti a mettere a punto alternative ai test su animali nella ricerca medica.
Delle «3R», la prima (Replacement, sostituzione) risulta ancora di difficile attuazione, in quanto non esistono ancora metodi che permettono di verificare l'efficacia e le conseguenze su un organismo complesso. Nell'ultimo decennio sono stati fatti significativi passi avanti. I metodi sostitutivi sono per la maggior parte tecniche in vitro. Quelli impiegati nella ricerca farmaceutica comprendono tutte le tecniche più avanzate: colture cellulari e di tessuti, vegetali, micro-organismi, uova, tecnologie di immagine, modelli matematici e informatici.
La seconda «R» (Reduction, riduzione) ha lo scopo di ridurre il numero di animali impiegati in una procedura ottenendo lo stesso risultato e anche quello di evitare la reiterazione di test su animali. In questo senso ulteriori progressi nel riconoscimento reciproco tra gli Stati membri dell'Unione europea e tra Unione europea e Paesi terzi, mediante accordi bilaterali tra le rispettive autorità, avranno un effetto pratico ed efficace nel ridurre il numero di animali impiegati per fini scientifici o tecnologici.
La terza «R» (Refinement, perfezionamento) promuove una cultura dell'«attenzione» alla tutela e al benessere degli animali. Pianificazione della ricerca con sofisticati strumenti di programmazione, in modo da ridurre al minimo possibile la sofferenza e lo stress degli animali. Istituzione di migliori procedure per gli esperimenti. Alloggiamento degli animali in ambienti adatti a ogni specie, migliorando le opportunità di socializzazione e la qualità degli alimenti.
Queste «3R» permeano tutto il progetto di legge e si ritrovano, seppure non sempre esplicitate, nei vari articoli e negli allegati annessi. In particolare ne viene sottolineata l'importanza tra le finalità e ad essi è dedicato per la prima volta uno specifico articolo (articolo 8).
Reinserimento degli animali.
Il decreto legislativo n. 116 del 1992 prevede in una laconica disposizione all'articolo 6, comma 3, che l'animale in vita al termine di un esperimento può essere tenuto presso lo stabilimento utilizzatore o altro stabilimento di custodia o rifugio. Tranne qualche eccezione dovuta all'accortezza di alcune associazioni animaliste e degli stessi ricercatori, la prassi negli anni è stata quella di sopprimere gli animali al termine del ciclo sperimentale anche quando le loro condizioni di salute potevano permettere il mantenimento in vita. L'assenza di una specifica normativa non ci permette di avere oggi una panoramica generale circa il numero di animali salvati in questi anni.
L'articolo 5 della proposta di legge stabilisce una concreta opportunità di vita per gli animali che al termine delle procedure di ricerca sono ancora in buone condizioni di salute. Individua in base ad un elenco predisposto dal Ministero della salute le strutture di accoglienza che sono in grado di ospitare gli animali e di reinserirli a una vita consona alle loro caratteristiche etologiche e fisiologiche. Le strutture di accoglienza autorizzate dal Ministero dovranno preventivamente far conoscere agli stabilimenti utilizzatori la loro disponibilità a ricevere gli animali relativamente al numero e alle specie che sono in grado di ospitare. In questo modo il Ministero ha la possibilità di monitorare ogni anno quanti animali sono stati dati in affidamento ed a quali strutture di accoglienza. Nel 2003 gli animali utilizzati in Italia per fini di ricerca sono stati 886 mila (dato del Ministero della salute). Le attuali strutture di accoglienza, in Italia, sembrano in grado di poter ospitare circa 6 mila animali.
Animali geneticamente modificati.
Anche gli animali geneticamente modificati per la prima volta trovano una loro collocazione in una normativa italiana
Pag. 4
Campi di applicazione.
L'utilizzo degli animali nella ricerca è disciplinato quasi interamente a livello europeo e internazionale e pertanto il nostro Paese non lo può ignorare. È stata fatta comunque una scelta politica, ponderata sul sistema europeo e internazionale ma sicuramente un passo in avanti per la tutela degli animali. L'articolo 7, comma 2, prescrive in maniera chiara che non è possibile rilasciare autorizzazioni per progetti che prevedano l'uso di animali per dimostrazioni didattiche; per lo sviluppo, la produzione e il controllo dei prodotti finiti o dei loro ingredienti finalizzati alla cosmesi. Già dal 2003 non risulta presentato alcun progetto finalizzato alla cosmesi, e qualora ci fossero state richieste in tale senso il Ministero della salute non le avrebbe autorizzate, avendo già fatte proprie le restrizioni adottate in sede europea. Il divieto si estende anche per ricerche su prodotti finiti per uso domestico, per testare materiale bellico, per la produzione di anticorpi monoclonali tramite l'induzione dell'ascite, salvo che non risulti obbligatorio da legislazioni o da farmacopee nazionali o internazionali.
Formazione del personale.
Tutte le presone che direttamente o indirettamente utilizzano animali per fini di ricerca devono avere una formazione adeguata alla specie o alle specie utilizzate. Il decreto legislativo n. 116 del 1992, all'articolo 17, comma 2, rimanda a un decreto ministeriale l'individuazione delle figure professionali e della formazione necessaria. Tale decreto doveva essere emanato entro un anno, quindi nel 1993, ma non se n'è mai fatto nulla. Dopo dodici anni di attesa, i profili professionali trovano nella proposta di legge una definitiva legittimazione grazie al combinato disposto dell'articolo 9 e dell'Allegato 5. La competenza professionale del personale che manipola, gestisce e cura gli animali è una garanzia di benessere per gli animali stessi al fine di evitare stress e inutili sofferenze.
Comitati per la cura e l'utilizzo degli animali.
L'altra importante novità della proposta di legge è quella di prevedere che tutti i progetti che utilizzano animali prima di essere inviati al Ministero della salute per la richiesta di autorizzazione devono essere esaminati da un comitato locale il quale esprime sugli stessi una valutazione tecnico-scientifica. A questo fine è stata prevista dalla stessa proposta di legge la composizione minima del Comitato per garantire una adeguata professionalità. La relazione del Comitato è un ulteriore supporto dato al Ministero della salute per arrivare a decidere la concessione o il diniego dell'autorizzazione.
Osservatorio nazionale per la tutela degli animali da laboratorio.
L'Osservatorio nazionale istituito dall'articolo 15 della proposta di legge rappresenta un salto culturale, un «continuum» del clima di dialogo che si è instaurato nel Comitato di revisione per la riforma del decreto legislativo n. 116 del 1992. Un punto di incontro tra istituti di ricerca e associazioni animaliste per realizzare studi e approfondimenti sull'attuazione della legge, proporre modifiche e integrazioni alla stessa, promuovere lo studio e la validazione dei metodi alternativi. Una piattaforma istituzionale per aprire un confronto sull'evoluzione dell'uso degli animali per fini di ricerca che tenga conto della valutazione etica senza prescindere dal dato scientifico e dal contesto europeo e internazionale ma che si
Pag. 5
Regime di autorizzazione.
Il decreto legislativo n. 116 del 1992 prevede due regimi di autorizzazione. L'80 per cento dei progetti è comunicato al Ministero della salute in regime di autocertificazione. I progetti che prevedono l'uso di cani, gatti, primati non umani, quelli effettuati senza anestesia e le dimostrazioni didattiche devono essere invece autorizzati dal Ministero della salute. Questo tipo di regime negli anni si è dimostrato fallace per diversi aspetti. Il sistema delle autocertificazioni non è controllato dal Ministero della salute se non dopo che il progetto è iniziato o già terminato senza poter esprimere valutazioni od osservazioni. I tempi per la concessione delle autorizzazioni sono molto elevati aggirandosi dai tre mesi fino a un anno e mezzo e creando problemi agli stessi ricercatori.
La proposta di legge, al fine di rispondere alle richieste di maggiore certezza e trasparenza, prescrive che tutti i progetti che utilizzano animali devono essere preventivamente autorizzati.
Sono previsti due filtri, due livelli di valutazione. Il primo è rappresentato dal Comitato locale per la cura e l'utilizzo degli animali, che deve esprimere il suo parere motivato sul progetto (articolo 13). Il secondo dal Ministero della salute che con decreto dirigenziale autorizza la ricerca entro trenta giorni dalla data di richiesta di autorizzazione, entro sessanta giorni per i progetti che utilizzano cani, gatti, primati non umani, animali geneticamente modificati e progetti che non prevedono l'uso dell'anestesia. Per rendere certi i tempi non solo sulla carta è stato previsto il regime del silenzio-assenso. Trascorsi i termini previsti dalla legge, nel silenzio del Ministero, è possibile cominciare la ricerca. La trasparenza, intesa nel senso di conoscere la competenza del personale preposto a effettuare la ricerca, le finalità della ricerca stessa e le modalità di impiego degli animali nelle procedure, è garantita dall'Allegato 4, ossia la domanda con cui il ricercatore chiede l'autorizzazione al Ministero. Il ricercatore deve motivare in maniera minuziosa l'utilizzo degli animali e le procedure alle quali sono preposti, e deve attenersi a quanto dichiarato al Ministero. A garantire la valenza tecnico-scientifica del progetto è il Comitato locale composto da esperti del settore con il compito di analizzare la validità del progetto. Il tempo apparentemente ristretto per il rilascio delle autorizzazioni da parte del Ministero è filtrato dal Comitato locale che esprime un preventivo parere sul progetto posto alla sua valutazione e di cui il Ministero dovrà tenere conto ai fini del rilascio della autorizzazione.
In conclusione, questo testo di revisione della disciplina dettata dal decreto legislativo n. 116 del 1992 risponde ad un'esigenza migliorativa della normativa vigente: una più chiara e omogenea trattazione della materia, una più adeguata precisione terminologica, maggiori certezze riguardo alle procedure autorizzative, maggiore responsabilità per chi utilizza animali da laboratorio. Rappresenta sicuramente un avanzamento culturale di grande rilevanza sociale, essendo il risultato tra le posizioni da sempre confliggenti tra il mondo della ricerca e le associazioni per la protezione e la tutela degli animali. Divisi sui propri convincimenti, ma uniti per raggiungere un risultato comune: maggiore tutela, più rispetto, meno animali utilizzati, una migliore ricerca. Per queste ragioni, se ne raccomanda la sollecita approvazione.
Pag. 6
1. La presente legge, in recepimento della direttiva 86/609/CEE del Consiglio, del 24 novembre 1986, e successive modificazioni, stabilisce le norme per la protezione e la tutela degli animali utilizzati per fini scientifici o tecnologici, descrive le condizioni necessarie a garantirne il benessere, incentiva lo sviluppo e l'impiego di metodi alternativi all'uso di animali.
2. È consentito l'utilizzo degli animali per fini scientifici o tecnologici soltanto quando, per ottenere il risultato ricercato, non sia possibile utilizzare altro metodo scientificamente valido, ragionevolmente e praticamente applicabile che non implichi l'impiego di animali.
1. Ai sensi della presente legge si intende per «animale», non altrimenti specificato, qualsiasi vertebrato vivo non umano inclusi quelli geneticamente modificati, gli animali invertebrati cefalopodi appartenenti all'ordine dei decapodi, le forme larvali autonome e/o capaci di riprodursi, ad esclusione di altre forme fetali o embrionali.
2. L'Allegato 1 annesso alla presente legge precisa le specie di animali che possono essere utilizzate soltanto se nate e allevate in cattività e provenienti da uno stabilimento di allevamento o di fornitura autorizzato dalle autorità competenti nazionali o dei Paesi in cui hanno origine gli animali.
3. È vietato l'impiego di animali selvatici e delle specie in via di estinzione di cui alla convenzione sul commercio internazionale delle specie animali e vegetali in via di estinzione, firmata a Washington il
Pag. 7
4. È vietato l'utilizzo delle scimmie antropomorfe, ovvero scimpanzé, bonobo, gorilla e orango, salvo che si ritenga indispensabile ai fini della cura di malattie delle specie stesse o della loro conservazione.
1. Ai sensi della presente legge si definisce:
a) «procedura», la tecnica o la combinazione di più tecniche condotte su un animale che possa essere causa di dolore, sofferenza, forte stress, di danni temporanei o durevoli, compresa qualsiasi manipolazione, anche genetica, che determini la nascita di un animale in tali condizioni;
b) «progetto», l'insieme delle procedure in cui vengano utilizzati anche animali, a partire dalla loro preparazione alla prima procedura fino a quando non occorrano ulteriori interventi od osservazioni ai fini del progetto in corso.
2. L'eliminazione del dolore, della sofferenza, del forte stress, dei danni temporanei o durevoli, in conseguenza dell'applicazione di un anestetico, di un analgesico o di altri metodi similari, non pone l'animale al di fuori dei campi di applicazione definiti dalla presente legge.
1. L'utilizzo degli animali deve essere condotto in maniera responsabile, in particolare non è ammissibile provocare, con
Pag. 8
2. Qualora l'utilizzo di animali non sia evitabile, si deve motivare all'autorità competente di cui all'articolo 14 la necessità del ricorso ad una o più specie e il tipo di procedure che si intendono condurre.
3. Tra le varie procedure, devono essere scelte quelle che, a parità di risultati:
a) richiedono il minor numero di animali;
b) utilizzano animali con il più basso sviluppo neurologico;
c) sono in grado di minimizzare stress, dolore, sofferenza o danni durevoli;
d) hanno il più favorevole rapporto tra danno e beneficio.
4. I progetti devono necessariamente tenere conto dello stato del progresso scientifico o tecnologico.
5. L'utilizzo degli animali è vincolato al rispetto delle procedure descritte nella richiesta di autorizzazione ai sensi dell'Allegato 4 annesso alla presente legge.
6. L'utilizzo degli animali può avere luogo solo all'interno di stabilimenti utilizzatori che hanno preventivamente ottenuto l'autorizzazione dal Ministero della salute ai sensi dell'articolo 10.
7. Non possono essere utilizzati animali dei quali non è documentata la provenienza.
8. Tutte le procedure e le tecniche in grado di indurre dolore o sofferenza nell'animale devono essere condotte in anestesia generale o locale, tranne i casi in cui si ritiene che l'anestesia sia per l'animale più traumatica della procedura stessa ovvero sia incompatibile con la finalità del progetto; cessati gli effetti dell'anestesia o quando questa non è possibile, gli animali devono essere immediatamente sottoposti a un trattamento analgesico adeguato a ridurre la percezione del dolore o della sofferenza, a meno che sia incompatibile con i fini del progetto.
Pag. 9
9. Quando permangono condizioni di sofferenza insostenibili, si deve procedere immediatamente alla soppressione dell'animale con metodi umanitari sotto la responsabilità del medico veterinario di cui al comma 6 dell'articolo 9. È considerata sofferenza insostenibile quella che nella normale pratica veterinaria costituisce indicazione per l'eutanasia.
10. È vietato eseguire sugli animali interventi che li rendono afoni e sono altresì vietati il commercio, l'acquisto e l'uso di animali resi afoni. Non è permesso fare uso di alcun mezzo volto ad impedire o a limitare l'espressione del dolore; è altresì vietato l'uso di agenti di blocco neuromuscolare, qualora abbiano il solo scopo di evitare o di limitare l'espressione del dolore.
11. Nessun animale può essere impiegato in più di una procedura che ha provocato forte dolore o danni durevoli, tranne quando la procedura successiva è praticata sotto anestesia generale da cui l'animale non si risveglia.
1. Al termine della procedura, o per qualsiasi eventuale interruzione della stessa, il medico veterinario responsabile del benessere decide se l'animale deve essere soppresso o mantenuto in vita e, congiuntamente al responsabile del progetto e al responsabile dell'esecuzione delle procedure, se l'animale mantenuto in vita può essere affidato alle strutture di accoglienza di cui al comma 3.
2. L'animale che può essere mantenuto in vita o che, ai sensi dell'articolo 4, comma 11, non può essere impiegato in una diversa procedura, è affidato alle strutture di accoglienza di cui al comma 3 che ne facciano preventivamente richiesta, al fine del reinserimento.
3. Il Ministero della salute, entro sei mesi dalla data di entrata in vigore della presente legge, previa verifica delle strutture, istituisce un elenco informatico delle
Pag. 10
4. L'autorizzazione di cui al comma 3 deve specificare:
a) a quali specie di animali è riferita l'autorizzazione;
b) il numero di animali per ogni specie considerata che la struttura è in grado di ospitare;
c) il responsabile della struttura e il personale addetto al mantenimento e al reinserimento degli animali;
d) il medico veterinario responsabile della cura e del benessere degli animali.
5. Il responsabile del progetto e il medico veterinario responsabile forniscono alla struttura di accoglienza di cui al comma 3 tutte le informazioni utili al buon esito del reinserimento.
6. Il responsabile dello stabilimento utilizzatore comunica ogni anno al Ministero della salute e alle aziende sanitarie locali (ASL) competenti per territorio il numero e le specie degli animali per cui è stato deciso il reinserimento e la struttura alla quale sono stati affidati.
7. Gli organi di cui all'articolo 17 effettuano controlli periodici per la verifica dell'idoneità delle strutture di accoglienza e delle condizioni di benessere degli animali ivi ospitati.
8. Le strutture di accoglienza di cui al comma 3 si fanno carico di tutte le spese inerenti al trasporto e al mantenimento degli animali e si assumono la responsabilità di assicurare agli animali le migliori condizioni di vita in accordo con le esigenze fisiologiche ed etologiche della loro specie.
9. Le strutture di accoglienza comunicano per via telematica in un apposito registro collegato alla banca dati di cui all'articolo 16:
a) la disponibilità per l'accoglienza, specificando le specie animali alle quali si riferiscono;
Pag. 11
b) il numero e le specie degli animali accolti e la loro provenienza;
c) il numero e le specie degli animali reinseriti, deceduti ed affidati.
10. Nei casi descritti dal comma 1 e qualora non vi sia disponibilità delle strutture di accoglienza a ricevere gli animali, gli stabilimenti utilizzatori possono provvedere alla soppressione degli stessi.
11. In nessun caso gli animali affidati alle strutture di accoglienza possono essere reintrodotti in ambienti naturali.
1. Ai sensi della presente legge, si intende per «geneticamente modificato» l'animale che contiene sequenze integrate di DNA clonato, denominato «transgene», trasferibili alla prole, inserite utilizzando tecniche di ingegneria genetica, ivi incluse le tecniche di trasferimento e di sostituzione genetica.
2. La generazione di nuovi ceppi di animali geneticamente modificati deve tenere conto della valutazione del rapporto tra danno e beneficio, e in particolare:
a) dell'effettiva necessità della manipolazione, la cui opportunità scientifica è valutata in rapporto alle sofferenze che possono essere inflitte, anche involontariamente, agli animali in conseguenza della manipolazione;
b) del possibile impatto che la manipolazione genetica potrebbe avere sul benessere degli animali;
c) dei potenziali rischi per la salute umana e animale;
d) della tutela dell'ambiente;
e) del prevedibile tasso di successo della manipolazione e, di conseguenza, del numero di animali eccedentari che dovranno essere soppressi;
f) dei problemi etici connessi.
Pag. 12
3. Il mantenimento e l'allevamento di animali geneticamente modificati con fenotipo sofferente devono essere autorizzati dal Ministero della salute.
4. Gli animali geneticamente modificati devono essere opportunamente distinguibili e facilmente identificabili dagli altri animali, mediante un apposito registro nel quale devono risultare chiari la loro provenienza, l'allevamento, le modalità di trasporto e di contenimento.
5. Gli stabilimenti in cui si generano, allevano, mantengono o utilizzano gli animali geneticamente modificati devono avere locali adeguati, assicurare un corretto contenimento ed essere dotati di sistemi che permettano di evitare il rischio di rilascio accidentale nell'ambiente.
6. Gli stabilimenti in cui si allevano animali geneticamente modificati di cui al comma 3 devono comunicare annualmente al Ministero della salute il numero di animali nati, alloggiati, forniti e soppressi.
7. Al fine di evitare rischi accidentali di rilascio nell'ambiente, il trasporto degli animali geneticamente modificati deve avvenire in condizioni di sicurezza. In particolare, durante il trasporto gli animali devono poter essere identificati e fisicamente separati dai cospecifici non geneticamente modificati.
8. In caso di rilascio accidentale nell'ambiente, il responsabile dello stabilimento di provenienza deve comunicare immediatamente il fatto al Ministero della salute e alla ASL competente per territorio.
1. L'impiego degli animali utilizzati per fini scientifici o tecnologici è consentito esclusivamente per uno o più dei seguenti campi di applicazione:
a) ricerca biomedica di base e applicata, inclusi le tesi di laurea sperimentali e i dottorati di ricerca inseriti all'interno dei progetti;
Pag. 13
b) attività di sviluppo, produzione e controllo di alimenti, farmaci, sieri, vaccini, presìdi medico-chirurgici, dispositivi medici e di qualsivoglia sostanza o prodotto per la profilassi, diagnosi o cura di malattie, anomalie e altri cattivi stati di salute nell'uomo, negli animali e per la salvaguardia dell'ambiente o delle piante;
c) sviluppo e messa a punto di tecniche e di metodologie medico-chirurgiche o dispositivi medici, formazione del personale preposto alla profilassi, diagnosi o cura di malattie, anomalie o altri cattivi stati di salute nell'uomo e negli animali;
d) prelievo di organi, tessuti o altri materiali biologici per lo svolgimento di procedure in vitro o in vivo, o che siano rivolte alla profilassi, diagnosi o cura di malattie, anomalie o altri cattivi stati di salute nell'uomo e negli animali;
e) saggi biologici per la tutela dell'ecosistema nell'interesse dell'uomo, degli animali e delle piante.
2. È vietato l'impiego di animali per:
a) la didattica;
b) lo sviluppo, la produzione e il controllo di prodotti finiti o dei loro singoli ingredienti o miscele di ingredienti finalizzati a uso cosmetico;
c) la produzione e il controllo di prodotti finiti per uso domestico;
d) la produzione e il controllo di materiale bellico;
e) test tossicologici con i protocolli della Lethal Dose - LD50 e della Lethal Concentration - LC50, tranne i casi in cui risulti obbligatorio da legislazioni o da farmacopee nazionali o internazionali;
f) la produzione di anticorpi monoclonali tramite l'induzione dell'ascite, qualora esistano corrispondenti altri metodi di produzione e non risulti obbligatorio da legislazioni o da farmacopee nazionali o internazionali.
Pag. 14
3. Sono escluse dal campo di applicazione della presente legge:
a) le pratiche agricolo-zootecniche o medico veterinarie professionali diverse da quelle finalizzate ad uso scientifico o tecnologico;
b) le prove di farmacocinetica residuale e le prove cliniche di campo di medicinali per uso veterinario negli insediamenti zootecnici su animali ivi allevati nonché le prove cliniche su animali da compagnia, previo consenso del proprietario, all'interno di ambulatori veterinari;
c) l'osservazione degli animali nel loro ambiente naturale o semi-naturale.
1. È considerato alternativo ogni metodo che elimina totalmente l'uso degli animali o che riduce il numero degli animali necessari ad eseguire una determinata procedura, o che impiega lo stesso numero di animali per ottenere un numero maggiore di informazioni pertinenti alla procedura ovvero ne raffina l'esecuzione diminuendo la sofferenza imposta all'animale.
2. I metodi alternativi validati dall'European Centre for the Validation of Alternative Methods (ECVAM) e adottati dalle linee guida OCSE, dalle direttive nazionali e internazionali per la registrazione dei farmaci e dall'Allegato V della direttiva 67/548/CEE del Consiglio, del 27 giugno 1967, e successive modificazioni, devono essere recepiti dal Ministero della salute e pubblicati nella Gazzetta Ufficiale come metodi ufficialmente riconosciuti.
3. Il Ministero della salute comunica per via telematica alla comunità scientifica il recepimento dei metodi alternativi di cui al comma 2 e le modalità necessarie per ottenere le eventuali autorizzazioni al loro utilizzo.
4. I test relativi alle prove obbligatorie di qualità, efficacia, innocuità e sicurezza di farmaci di uso umano o veterinario sono soggetti al rispetto delle specifiche
Pag. 15
5. Nella programmazione e nella pianificazione dei piani di ricerca scientifica applicata alla sanità umana e animale e alla salubrità dell'ambiente, sono incentivati:
a) i progetti che non si avvalgono dell'uso di animali;
b) i progetti che utilizzano metodi alternativi;
c) i progetti che utilizzano un minore numero di animali o comportano procedimenti meno dolorosi;
d) le ricerche su protocolli per il minore impiego di specie e di numero di animali;
e) le ricerche finalizzate allo studio di metodi alternativi.
1. Le persone che effettuano procedure e tecniche e quelle che si occupano direttamente o con compiti di controllo degli animali devono avere un'istruzione e una formazione adeguate, attinenti alle attività di loro competenza e alle specie utilizzate, al fine di garantire un uso scientificamente corretto degli animali impiegati.
2. In relazione al tipo di struttura, al numero, alle specie di animali mantenute e alla natura delle procedure, sono identificate le seguenti categorie di personale:
a) operatore di stabilimento; tecnico di stabilimento;
b) tecnico che collabora alla esecuzione delle procedure e delle tecniche;
c) responsabile del progetto; responsabile dell'esecuzione delle procedure e delle tecniche; ricercatore che partecipa alla pianificazione ed esecuzione delle procedure e delle tecniche;
d) responsabile dello stabilimento utilizzatore; responsabile dello stabilimento
Pag. 16
3. Nell'Allegato 5 annesso alla presente legge sono stabilite, per ciascuna categoria professionale di cui al comma 2, le mansioni e la formazione specifica richiesta.
4. Il responsabile dello stabilimento utilizzatore è il garante gestionale della struttura nei suoi aspetti amministrativi, organizzativi e sanitari; assicura il rispetto della legislazione vigente in materia; garantisce gli standard qualitativi; attesta la conformità della formazione del personale alle disposizioni di cui alla presente legge.
5. Il responsabile dello stabilimento di allevamento o di fornitura è il garante gestionale dello stabilimento, si occupa della gestione della struttura nei suoi aspetti amministrativi, organizzativi e sanitari; assicura il rispetto della legislazione vigente in materia; garantisce gli standard qualitativi; attesta la conformità della formazione del personale alle disposizioni di cui alla presente legge.
6. Il medico veterinario responsabile garantisce il benessere e il controllo sanitario degli animali; controlla la corretta esecuzione delle procedure e delle tecniche allo scopo di evitare danni, dolore, forte stress e sofferenze inutili; prescrive i trattamenti terapeutici necessari.
7. Il responsabile del progetto è il garante del progetto stesso nei suoi aspetti amministrativi e scientifici; fornisce indicazioni relative alla sicurezza degli agenti utilizzati.
8. Il responsabile dell'esecuzione delle procedure e delle tecniche è il garante di tutte le manipolazioni a cui vengono sottoposti gli animali all'interno di uno specifico progetto.
9. Non è consentito rivestire contemporaneamente la figura di responsabile del progetto o dell'esecuzione delle procedure e delle tecniche e quella di medico veterinario responsabile del benessere. L'incarico di medico veterinario responsabile non può essere attribuito a veterinari afferenti a strutture pubbliche di vigilanza sull'utilizzo degli animali per fini scientifici o tecnologici.
Pag. 17
10. Le procedure e le tecniche devono essere eseguite, direttamente o sotto la loro diretta responsabilità, da laureati in medicina e chirurgia, medicina veterinaria, biologia, scienze naturali, farmacia, chimica e tecnologie farmaceutiche, psicologia ad indirizzo generale e sperimentale o personale universitario docente ed equiparato nei settori scientifico-disciplinari MED, BIO-05, BIO-06, BIO-07, BIO-08, BIO-09, BIO-10, BIO-11, BIO-12, BIO-13, BIO-14, BIO-15, BIO-16, BIO-17, BIO-18, BIO-19, AGR-17, AGR-18, AGR-19, AGR-20, VET, CHIM-08, CHIM-09, CHIM-10, MPSI-02, di cui all'Allegato A annesso al decreto del Ministro dell'università e della ricerca scientifica e tecnologica 4 ottobre 2000, pubblicato nel supplemento ordinario alla Gazzetta Ufficiale n. 249 del 24 ottobre 2000, o da persone munite di altro titolo riconosciuto idoneo o equivalente con decreto del Ministro della salute.
11. Sono autorizzati a svolgere attività formativa in materia di preparazione professionale del personale di cui al comma 2:
a) le università;
b) l'Istituto superiore di sanità;
c) le associazioni scientifiche di settore e gli enti pubblici e privati, accreditati per la formazione del personale dalla Commissione per la didattica di cui al comma 12 o da organismi equivalenti in ambito europeo.
12. Allo scopo di uniformare la formazione degli operatori, anche al fine di armonizzare le figure professionali agli indirizzi comunitari e di agevolare la libera mobilità dei lavoratori in ambito europeo e internazionale attraverso il mutuo riconoscimento delle competenze, entro due mesi dalla data di entrata in vigore della presente legge è istituita la Commissione per la didattica, con i seguenti compiti:
a) formulazione dei programmi e di syllabus comuni a livello nazionale, secondo le linee guida europee adottate in materia;
Pag. 18
b) preparazione dei prototipi di esame per il rilascio dell'abilitazione secondo i vari livelli;
c) valutazione dei docenti per l'attività didattica dei corsi di formazione;
d) accreditamento di associazioni scientifiche di settore e di istituzioni pubbliche o private per la formazione del personale;
e) riconoscimento dei titoli di studio stranieri.
13. All'istituzione della Commissione per la didattica provvede il Ministro della salute, con proprio decreto, emanato di concerto con il Ministro dell'istruzione, dell'università e della ricerca.
14. La Commissione per la didattica è composta pariteticamente da rappresentanti del Ministero della salute, del Ministero dell'istruzione, dell'università e della ricerca, dell'Istituto superiore di sanità e di associazioni scientifiche e di enti con comprovata competenza in scienza degli animali da laboratorio.
15. La Commissione per la didattica valuta l'aggiornamento e l'adeguamento dei programmi di cui al comma 12 in base al progresso delle conoscenze scientifiche e tecnologiche in materia, avvalendosi anche di ulteriori competenze che si rendano necessarie.
16. I membri della Commissione per la didattica restano in carica per un triennio e possono essere rinnovati.
17. Entro sei mesi dalla costituzione della Commissione per la didattica, il Ministro della salute, di concerto con il Ministro dell'istruzione, dell'università e della ricerca, sentita la Conferenza permanente per i rapporti tra lo Stato, le regioni e le province autonome di Trento e di Bolzano, emana un decreto recante il piano didattico elaborato dalla medesima Commissione.
1. Ai sensi della presente legge è considerato stabilimento utilizzatore qualsiasi
Pag. 19
2. Chiunque intende porre in esercizio uno stabilimento utilizzatore deve ottenere la preventiva autorizzazione dal Ministero della salute, presentando i documenti di cui all'Allegato 3 annesso alla presente legge.
3. L'autorizzazione di cui al comma 2 deve obbligatoriamente indicare il responsabile dello stabilimento utilizzatore e il medico veterinario responsabile del benessere degli animali.
4. Ai fini di cui al comma 2 il Ministero della salute accerta:
a) che gli impianti e le attrezzature siano adeguati alle specie di animali stabulate e alle procedure che vi saranno effettuate;
b) che le strutture per gli animali geneticamente modificati garantiscano contenimenti adeguati ed efficienti atti a prevenire un rilascio accidentale nell'ambiente;
c) che le qualifiche e le competenze del responsabile dello stabilimento, del medico veterinario responsabile e del personale addetto allo stabilimento utilizzatore e alla cura e al benessere degli animali soddisfino le condizioni previste dall'articolo 9;
d) che, in base alla tipologia della struttura, delle procedure e al numero degli animali e specie alloggiati, sia presente un numero adeguato di persone qualificate per garantire la cura e il controllo giornaliero degli animali nonché il corretto funzionamento della struttura.
5. Il Ministero della salute, fermo restando il rispetto delle disposizioni vigenti in materia di protezione dei dati personali e della proprietà intellettuale, istituisce un elenco informatico degli stabilimenti utilizzatori autorizzati sul territorio nazionale.
6. Il responsabile dello stabilimento utilizzatore deve indicare in un apposito archivio informatico:
a) la data di arrivo degli animali nello stabilimento;
Pag. 20
b) la provenienza degli animali;
c) la specie, il ceppo, il numero, il sesso e la data di nascita o l'età di ogni animale o lotto di animali, nonché le loro condizioni di salute;
d) il codice del lotto o gli eventuali codici di identificazione individuali degli animali;
e) l'ubicazione dell'alloggiamento degli animali;
f) le date di inizio e di termine della procedura per gli animali effettivamente utilizzati, con l'indicazione del responsabile della procedura;
g) gli animali deceduti o soppressi con l'indicazione della data di morte;
h) le specie e il numero di animali destinati al reinserimento, con l'indicazione dell'istituzione affidataria e la data di uscita dallo stabilimento utilizzatore;
i) le specie e il numero di animali ceduti ad altri stabilimenti.
7. Gli animali geneticamente modificati devono essere opportunamente identificati secondo i criteri stabiliti al comma 6.
8. Gli stabilimenti utilizzatori possono ricevere animali esclusivamente dagli stabilimenti di allevamento o di fornitura autorizzati o da insediamenti zootecnici regolarmente registrati presso le ASL competenti per territorio.
9. Gli animali allevati per finalità correlate al progetto possono essere ceduti ad un altro stabilimento utilizzatore soltanto a titolo gratuito.
10. Ai fini del comma 9 è possibile importare animali da stabilimenti utilizzatori riconosciuti e autorizzati nel Paese di origine.
11. Qualora i casi previsti dai commi 9 e 10 riguardino animali geneticamente modificati, ne deve essere data immediata comunicazione al Ministero della salute, specificando il destinatario, le finalità della cessione, il numero e le specie di animali ceduti.
Pag. 21
12. Le spese relative ai controlli necessari per il rilascio dell'autorizzazione previsti dal presente articolo sono poste a carico del richiedente l'autorizzazione stessa.
1. Ai sensi della presente legge è considerato:
a) «stabilimento di allevamento», qualsiasi stabilimento in cui gli animali vengono allevati al solo scopo di essere successivamente utilizzati in uno stabilimento utilizzatore;
b) «stabilimento di fornitura», qualsiasi stabilimento, diverso da quello di allevamento, che fornisce animali destinati agli stabilimenti utilizzatori.
2. Gli stabilimenti di allevamento e di fornitura possono ricevere animali importati soltanto da stabilimenti in cui i requisiti di benessere sono garantiti dall'autorità competente del Paese di appartenenza.
3. Gli animali importati, appartenenti alle specie di cui all'Allegato 1 annesso alla presente legge, devono essere generati in cattività.
4. È compito dello stabilimento di allevamento o di fornitura verificare e certificare la provenienza e l'identificazione di ogni animale importato.
5. Il comune rilascia l'autorizzazione all'apertura di stabilimenti di allevamento o di fornitura e ne trasmette copia al Ministero della salute, alla regione, alla ASL e alla prefettura-ufficio territoriale del Governo competenti per territorio.
6. L'autorizzazione di cui al comma 5 deve indicare il responsabile dello stabilimento, il medico veterinario responsabile del benessere e dello stato sanitario degli animali, nonché il personale adibito alla assistenza degli animali e al funzionamento delle attrezzature.
7. Il personale di cui al comma 6 deve soddisfare le condizioni di formazione prescritte dall'articolo 9 e dall'Allegato 5 annesso alla presente legge.
Pag. 22
8. I cani, i gatti, i primati non umani e i cavalli presenti negli stabilimenti di allevamento o di fornitura devono essere dotati di un microchip o di altro strumento di riconoscimento individuale applicato dal medico veterinario responsabile del benessere e dello stato sanitario degli animali.
9. Il responsabile dello stabilimento di allevamento o di fornitura deve annotare in un apposito archivio elettronico:
a) il numero e le specie di animali presenti nello stabilimento, l'età e il sesso degli animali, nonché i codici di riconoscimento di cui al comma 8 o i lotti degli animali nati nello stabilimento e degli animali di diversa provenienza;
b) il numero e le specie, l'età, il sesso e gli eventuali codici di riconoscimento individuali o dei lotti degli animali forniti, la data del ricevimento dell'ordine, la data di effettuazione della fornitura e l'indirizzo del destinatario;
c) il numero degli animali morti nello stabilimento, specificando, quando possibile, la causa del decesso.
10. Almeno una volta all'anno i servizi veterinari della ASL competente per territorio controllano la corrispondenza tra le annotazioni degli archivi di cui al comma 9 e gli animali presenti nello stabilimento interessato.
11. La vendita degli animali agli stabilimenti utilizzatori è effettuata previa richiesta di copia dell'autorizzazione all'utilizzo degli animali rilasciata dal Ministero della salute.
12. In caso di esportazione di animali deve essere richiesta e conservata copia dell'autorizzazione dello stabilimento di allevamento, di fornitura o utilizzatore, rilasciata dall'autorità nazionale competente.
1. Chiunque alleva, fornisce o utilizza animali per fini di ricerca deve provvedere,
Pag. 23
a) gli animali siano tenuti in un ambiente che consenta una certa libertà di movimento e fruiscano di alimentazione, acqua e cure adeguate alla loro salute e al loro benessere;
b) sia ridotta al minimo qualsiasi limitazione alla possibilità di soddisfare i bisogni fisiologici e comportamentali dell'animale;
c) siano effettuati controlli quotidiani per verificare le condizioni fisiche in cui gli animali sono allevati, tenuti o utilizzati;
d) un medico veterinario controlli il benessere e le condizioni di salute degli animali allo scopo di evitare danni durevoli, dolore, inutili sofferenze o forte stress.
2. Il personale addetto al mantenimento e alla cura degli animali verifica quotidianamente le condizioni fisiche in cui gli animali sono allevati, tenuti o utilizzati, informando tempestivamente il medico veterinario responsabile del benessere e dello stato sanitario in caso di insorgenza di stati di sofferenza o forte stress negli animali.
3. Il medico veterinario responsabile controlla le condizioni di salute e il benessere degli animali, assicura il corretto trattamento in tutte le fasi delle singole tecniche o procedure, allo scopo di evitare danni durevoli, dolore, sofferenza o forte stress inutili.
4. L'Allegato 2 annesso alla presente legge prescrive le modalità di sistemazione e le condizioni di permanenza degli animali negli stabilimenti di cui agli articoli 10 e 11.
5. Le autorizzazioni all'apertura degli stabilimenti utilizzatori, di allevamento o di fornitura, sono concesse previa verifica della conformità delle strutture alle disposizioni dell'Allegato 2 annesso alla presente legge.
Pag. 24
1. Ciascun ente di ricerca pubblico e privato che utilizza animali per fini scientifici o tecnologici istituisce un Comitato per la cura e l'utilizzo degli animali, di seguito denominato «Comitato».
2. Il Comitato ha i seguenti compiti:
a) esprimere il parere sui progetti entro trenta giorni dalla data di presentazione della relativa domanda;
b) promuovere l'aggiornamento professionale del personale addetto all'utilizzo degli animali;
c) redigere, a cadenza annuale, un rapporto complessivo sull'andamento dei propri lavori da trasmettere al Ministero della salute.
3. Nell'analisi dei progetti, il Comitato deve considerare:
a) la rilevanza tecnico-scientifica del progetto;
b) la corretta applicazione della presente legge;
c) gli obblighi derivanti dalle normative europee e internazionali o dalle farmacopee ufficiali per lo sviluppo e la sicurezza dei farmaci e i saggi tossicologici relativi a sostanze chimiche e naturali;
d) la possibilità di sostituire una o più tecniche o procedure con i metodi alternativi di cui all'articolo 8;
e) l'adeguata formazione e la congruità dei ruoli professionali del personale utilizzatore indicato nel progetto.
4. Il Comitato comunica le proprie decisioni con parere motivato comprensivo del responso di ogni suo componente.
5. Ogni Comitato è composto almeno da:
a) tre esperti nell'utilizzo di animali per fini scientifici o tecnologici;
Pag. 25
b) un medico veterinario responsabile del benessere e dello stato sanitario degli animali;
c) un esperto in materie scientifico-tecnologiche che non utilizza animali o un esperto in metodi alternativi.
6. Ai fini della propria composizione, il Comitato deve garantire la proporzionalità delle componenti elencate al comma 5.
7. I membri del Comitato eleggono il proprio presidente e adottano un apposito regolamento per la disciplina delle attività.
8. Il Ministero della salute cura la tenuta di un elenco informatico dei Comitati, provvedendo al suo costante aggiornamento.
9. Gli stabilimenti utilizzatori possono affidare i compiti previsti dal presente articolo ad un Comitato operante in un ente diverso da quello loro afferente.
10. I componenti del Comitato assolvono il loro mandato in regime di riservatezza.
1. Ogni progetto che implica l'utilizzo degli animali deve essere preventivamente autorizzato dal Ministero della salute.
2. Al fine di cui al comma 1 è istituito presso il Ministero della salute un sistema informatizzato di documentazione.
3. Il responsabile del progetto compila per via telematica i moduli previsti dall'Allegato 4 annesso alla presente legge, corredati dal parere del Comitato e dalla relativa documentazione.
4. Per il rilascio delle autorizzazioni il Ministero della salute valuta il rapporto tra danno e beneficio, e in particolare:
a) il parere del Comitato;
Pag. 26
b) che sono state prese in considerazione tutte le alternative all'utilizzo di animali;
c) che la ricerca non costituisce una inutile duplicazione di ricerche precedenti;
d) che sono dichiarate le finalità del progetto e delle procedure adottate;
e) che la competenza professionale del personale designato a condurre le procedure e le tecniche è conforme a quanto previsto dalla presente legge;
f) che il ricorso ad una determinata specie di animale è sufficientemente motivato;
g) che vengono utilizzati numeri minimi di animali per il raggiungimento delle finalità del progetto;
h) che sono state prese tutte le precauzioni possibili per prevenire o ridurre al minimo il dolore, la sofferenza e il forte stress nelle procedure ovvero per sostituire le procedure dolorose con tecniche diverse;
i) che nel corso delle procedure e delle tecniche che provocano dolore, sofferenza o forte stress vengono utilizzati anestetici, analgesici o ansiolitici adeguati;
l) che sono giustificate le vie di somministrazione dei preparati;
m) che vengono utilizzati metodi adeguati di eutanasia.
5. Il Ministero della salute, entro trenta giorni dalla data di ricezione della domanda per la concessione dell'autorizzazione ai sensi del comma 1, comunica l'esito della sua valutazione.
6. Per i progetti che implicano l'utilizzo di primati non umani, animali geneticamente modificati, cani, gatti e cavalli ovvero in caso di progetti che non prevedono l'uso di anestesia ai sensi del comma 8 dell'articolo 4 o che provocano agli animali danni riferibili alla classe 3 descritta dalla sezione 9 dell'Allegato 4 annesso alla presente legge, il Ministero della salute
Pag. 27
7. Qualora il Ministero della salute non si sia pronunciato entro i termini di cui ai commi 5 e 6, i progetti si considerano autorizzati.
8. Ai fini della valutazione, il Ministero della salute può richiedere una volta soltanto al responsabile del progetto ulteriori informazioni o chiarimenti.
9. Nel caso di cui al comma 8, il termine per la valutazione dei progetti è sospeso fino all'avvenuta ricezione delle informazioni o dei chiarimenti da parte del responsabile del progetto.
10. Il Ministero della salute può subordinare la concessione dell'autorizzazione al recepimento delle sue indicazioni.
11. Tutte le informazioni inviate al Ministero della salute devono avvenire esclusivamente per via telematica a mezzo del sistema informatizzato di cui al comma 2.
12. Le autorizzazioni hanno validità triennale con possibilità di rinnovo; entro sessanta giorni dalla data di scadenza dell'autorizzazione il responsabile del progetto può chiedere l'autorizzazione alla prosecuzione del progetto.
13. I progetti autorizzati in esecuzione di obblighi derivanti da normative europee o internazionali o dalle farmacopee ufficiali sono automaticamente rinnovati mediante comunicazione al Ministero della salute.
14. Il responsabile del progetto comunica al Ministero della salute, mediante il sistema informatizzato di cui al comma 2, le eventuali variazioni relative alle informazioni di cui all'Allegato 4 annesso alla presente legge.
15. Al fine di una migliore valutazione delle procedure e delle tecniche previste dal progetto, il Ministero della salute, ove lo ritenga opportuno, può richiedere una perizia tecnico-scientifica ad esperti dell'Istituto superiore di sanità o del Consiglio superiore di sanità nelle materie di pertinenza del progetto stesso.
16. Nel caso in cui il Comitato non fornisca il proprio parere nel termine di
Pag. 28
17. Nel caso di cui al comma 16, il Ministero della salute sollecita il Comitato competente ad esprimere il proprio parere non oltre quindici giorni dalla data della richiesta. In caso di mancata risposta, il Ministero della salute effettua tutti gli accertamenti al fine della valutazione del progetto entro sessanta giorni dallo scadere del citato termine di quindici giorni.
18. Il Ministero della salute emana le sue decisioni con apposito decreto eventualmente corredato dalle perizie tecnico-scientifiche richieste ai sensi del comma 15. In caso di diniego dell'autorizzazione, il Ministero della salute motiva le sue decisioni.
1. È istituito presso il Ministero della salute l'Osservatorio nazionale per la tutela degli animali da laboratorio, di seguito denominato «Osservatorio», con i seguenti compiti:
a) proporre modifiche, integrazioni o approfondimenti della presente legge tenendo conto del progresso scientifico e dell'evoluzione delle decisioni in ambito europeo e internazionale;
b) realizzare studi e analisi sull'attuazione della presente legge, anche con l'ausilio dei dati contenuti nella banca dati di cui all'articolo 16;
c) promuovere lo studio e la validazione dei metodi alternativi.
2. L'Osservatorio è presieduto da un dirigente del Ministero della salute responsabile dell'utilizzo degli animali per fini di ricerca ed è composto da rappresentanti dell'università, dell'Istituto superiore di sanità, del Consiglio nazionale delle ricerche, di altri enti di ricerca pubblici e privati
Pag. 29
3. I componenti dell'Osservatorio sono nominati dal Ministro della salute, previo parere delle Commissioni parlamentari competenti, espresso entro sessanta giorni dalla data di trasmissione della lista dei nominativi dei candidati; in mancanza di tale parere, il Ministro della salute procede comunque alla nomina. Ogni mandato ha durata triennale con possibilità di rinnovo.
4. L'Osservatorio disciplina i compiti di cui al comma 1 mediante l'adozione di un apposito regolamento. Le riunioni dell'Osservatorio hanno luogo almeno una volta ogni tre mesi.
5. L'Osservatorio presenta al Ministro della salute una relazione annuale comprensiva di tutti i dati statistici relativi all'impiego degli animali nella ricerca e sullo stato di attuazione della presente legge.
6. I componenti dell'Osservatorio assolvono il loro lavoro in regime di riservatezza, in ottemperanza alle disposizioni vigenti in materia di protezione dei dati personali e dei dati sensibili.
7. In caso di violazioni alle disposizioni di cui al comma 6 da parte di uno o più componenti dell'Osservatorio, il Ministro della salute provvede immediatamente alla revoca della nomina e alla relativa sostituzione.
1. È istituita, presso l'Ufficio per la tutela e il benessere degli animali della Direzione generale della sanità veterinaria e degli alimenti del Dipartimento della prevenzione e della comunicazione del Ministero della salute, una banca dati telematica per la raccolta dei dati relativi all'utilizzo degli animali in progetti per fini scientifici o tecnologici.
2. Il Ministero della salute controlla e gestisce l'esattezza e l'aggiornamento dei
Pag. 30
3. La banca dati telematica contiene:
a) il numero dei progetti autorizzati e respinti in riferimento ad ogni anno;
b) le relazioni integrali di cui al comma 5 dell'articolo 15;
c) la raccolta su base nazionale e internazionale di informazioni e di pubblicazioni relative all'impiego di metodi alternativi;
d) il collegamento in rete delle strutture di accoglienza per il reinserimento degli animali di cui al comma 9 dell'articolo 5;
e) l'elenco dei metodi alternativi validati e di quelli in corso di validazione;
f) l'elenco dei Comitati;
g) l'elenco degli stabilimenti utilizzatori;
h) l'elenco degli stabilimenti di allevamento e di fornitura;
i) l'elenco delle strutture di accoglienza di cui all'articolo 5 per il reinserimento degli animali;
l) l'elenco degli stabilimenti utilizzatori, di allevamento e di fornitura europei e dei Paesi terzi.
4. Gli elenchi di cui al comma 3 non devono contenere alcuna informazione che possa portare all'identificazione del personale di cui all'articolo 9.
1. Sono abilitati ad effettuare controlli presso gli stabilimenti utilizzatori, di allevamento, di fornitura e di accoglienza:
a) il Ministero della salute;
b) il servizio veterinario delle ASL;
c) gli organi di pubblica sicurezza.
Pag. 31
2. I soggetti di cui al comma 1 effettuano accertamenti in merito:
a) alla congruità tra i dati contenuti nei registri e gli animali effettivamente presenti negli stabilimenti utilizzatori, di allevamento, di fornitura e di accoglienza;
b) alla congruità tra le procedure autorizzate ed i procedimenti effettivamente eseguiti;
c) alla corrispondenza tra il livello e la durata della sofferenza prevista e quella effettivamente subita dagli animali;
d) alle condizioni di stabulazione degli animali relativamente a quanto stabilito dalle norme dell'Allegato 2 annesso alla presente legge;
e) alla qualifica professionale del personale di cui all'articolo 9.
3. I soggetti di cui al comma 1 eseguono i controlli di cui al comma 2 negli stabilimenti utilizzatori, di allevamento, di fornitura e di accoglienza presenti sul loro territorio di competenza almeno una volta all'anno e senza preavviso e comunicano immediatamente al Ministero della salute l'esito della loro indagine.
4. Al fine di assicurare un'adeguata competenza nei controlli, a garanzia del maggior benessere degli animali, i servizi veterinari delle ASL e gli organi di pubblica sicurezza possono avvalersi, per i compiti loro assegnati ai sensi del comma 1, di medici veterinari specialisti in scienza e medicina degli animali da laboratorio di cui all'articolo 9, comma 14, ovvero, per compiti specifici, della collaborazione di specialisti in scienza degli animali da laboratorio.
1. Le violazioni del comma 5 dell'articolo 4, salvo che il fatto costituisca reato, sono punite con la sanzione amministrativa da 3.000 euro a 18.000 euro; in caso di recidiva, la sanzione amministrativa è
Pag. 32
2. Le violazioni del comma 6 dell'articolo 4, salvo che il fatto costituisca reato, sono punite con la sanzione amministrativa da 5.000 euro a 30.000 euro.
3. Le violazioni del comma 10 dell'articolo 4, indipendentemente dall'esercizio dell'azione penale, sono punite con la sanzione amministrativa da 5.000 euro a 50.000 euro; in caso di violazione continuata o di recidiva, la sanzione amministrativa è aumentata di un terzo e il responsabile del progetto è sospeso per un massimo di cinque anni da ogni autorizzazione ad effettuare ricerche che implicano l'utilizzo di animali.
4. Le violazioni del comma 11 dell'articolo 4, salvo che il fatto costituisca reato, sono punite con la sanzione amministrativa da 3.000 euro a 30.000 euro; in caso di violazione continuata o di recidiva, la sanzione amministrativa è aumentata di un terzo.
5. Le violazioni dei commi 3 e 4 dell'articolo 2 e del comma 2, lettere a), b), c), d), e) e f), dell'articolo 7, salvo che il fatto costituisca reato, sono punite con la sanzione amministrativa da 10.000 euro a 60.000 euro. In caso di violazione continuata o di recidiva, la sanzione amministrativa è aumentata di un terzo ed i responsabili sono sospesi per un massimo di cinque anni da ogni autorizzazione ad effettuare ricerche che implicano l'utilizzo di animali.
6. Le violazioni dei commi 8 e 11 dell'articolo 5, indipendentemente dall'esercizio dell'azione penale, sono punite con la sanzione amministrativa da 3.000 euro a 30.000 euro e con la revoca dell'autorizzazione di cui al comma 3 del medesimo articolo 5.
7. Le violazioni del comma 3 dell'articolo 6 sono punite, indipendentemente dall'esercizio dell'azione penale, con la sanzione amministrativa da 3.000 euro a 30.000 euro e il responsabile del progetto è sospeso per un massimo di cinque anni da ogni autorizzazione ad effettuare ricerche che implicano l'utilizzo di animali.
Pag. 33
8. Le violazioni dei commi 5 e 7 dell'articolo 6 sono punite con la sanzione amministrativa da 3.000 euro a 15.000 euro. In caso di violazione del comma 7 del medesimo articolo 6, sono disposte la sospensione da tre mesi a tre anni dell'attività di trasporto e la confisca degli animali.
9. Chiunque effettua qualsiasi manipolazione od uso di animali in assenza dei requisiti professionali di cui all'articolo 9, salvo che il fatto costituisca reato, è punito con la sanzione amministrativa da 3.000 euro a 18.000 euro ed è esonerato da ogni tipo di attività sugli animali presso qualsiasi stabilimento fino al conseguimento del titolo abilitante ai sensi del citato articolo 9 e dell'Allegato 5 annesso alla presente legge. La stessa sanzione amministrativa aumentata di un terzo si applica al responsabile del progetto.
10. Il medico veterinario responsabile che omette la sua assistenza al mantenimento del benessere degli animali o la effettua con negligenza o con imperizia è deferito all'ordine dei medici veterinari competente e punito con la sanzione amministrativa da 3.000 euro a 15.000 euro.
11. Chiunque viola le disposizioni di cui all'articolo 12, salvo che il fatto costituisca reato, è punito con la sanzione amministrativa da 5.000 euro a 30.000 euro; in caso di violazione continuata o di recidiva, il massimo della sanzione amministrativa è aumentato fino a 50.000 euro e si procede alla sospensione dell'autorizzazione di cui al comma 2 dell'articolo 10 e al comma 5 dell'articolo 11 fino al corretto adeguamento delle strutture.
12. Tutte le altre violazioni delle disposizioni di cui alla presente legge sono punite con la sanzione amministrativa da 1.000 euro a 10.000 euro.
1. Il Ministero della salute raccoglie i dati statistici sulla produzione e sull'utilizzazione
Pag. 34
2. Non possono essere pubblicate informazioni pervenute al Ministero della salute in attuazione della presente legge quando rivestono un particolare interesse commerciale.
3. Il Ministero della salute comunica alla Commissione delle Comunità europee informazioni sulla legislazione e sulle pratiche amministrative relative alla protezione degli animali utilizzati per fini scientifici o tecnologici, ivi compresi gli obblighi cui ottemperare prima di commercializzare i prodotti nonché informazioni su tutte le ricerche che fanno uso di animali svolte nel territorio nazionale e sulle autorizzazioni o su ogni altro elemento di ordine amministrativo concernente tali ricerche.
4. Nell'ambito delle possibilità previste dalla legislazione vigente sul riordino del Ministero della salute, il Ministro della salute provvede ad assicurare all'Ufficio per la tutela e il benessere degli animali della citata Direzione generale della sanità veterinaria e degli alimenti di cui all'articolo 16, comma 1, un organico adeguato ad espletare le funzioni previste dalla presente legge fino ad un massimo di sei unità operative.
5. Il Ministro della salute, di concerto con il Ministro per l'innovazione e le tecnologie, entro sei mesi dalla data di entrata in vigore della presente legge, istituisce il sistema informatizzato di cui al comma 2 dell'articolo 14 e la banca dati telematica di cui all'articolo 16.
6. Gli Allegati annessi alla presente legge sono parte integrante della medesima. Il Ministro della salute può, con proprio decreto, modificare le linee di indirizzo degli Allegati annessi alla presente legge al fine di tenere conto dei progressi scientifici e tecnologici.
Pag. 35
7. I comuni, previo parere della ASL competente per territorio, possono autorizzare il prelievo in natura di specie di animali diverse da quelle elencate nell'Allegato 1 annesso alla presente legge.
8. A decorrere dalla data di entrata in vigore della presente legge è abrogato il decreto legislativo 27 gennaio 1992, n. 116.
1. Le strutture di accoglienza che prima della data di entrata in vigore della presente legge svolgevano funzioni di reinserimento degli animali da laboratorio hanno facoltà di continuare le loro prestazioni fino all'ottenimento dell'autorizzazione da parte del Ministero della salute ai sensi dell'articolo 5.
2. Gli stabilimenti utilizzatori, di allevamento e di fornitura che prima della data di entrata in vigore della presente legge già svolgevano tale funzione mantengono le autorizzazioni in essere.
3. Sono escluse dal conseguimento dei titoli abilitanti di cui all'articolo 9 le persone che, prima della data di entrata in vigore della presente legge, svolgevano regolarmente tali funzioni da almeno sei mesi presso uno stabilimento utilizzatore, di allevamento o di fornitura.
4. Al fine di cui al comma 3, il responsabile di ogni stabilimento utilizzatore, di allevamento o di fornitura, entro tre mesi dalla data di entrata in vigore della presente legge, comunica al Ministero della salute il numero e le generalità del personale impiegato specificandone la qualifica ai sensi dell'articolo 9.
5. Fino alla data di entrata in vigore del sistema informatizzato di cui al comma 5 dell'articolo 19, le relative autorizzazioni sono rilasciate dal Ministero della salute ai sensi dell'articolo 14 in forma cartacea secondo le modalità previste da una apposita circolare ministeriale.
6. I progetti autorizzati e le comunicazioni eventualmente in essere prima della data di entrata in vigore della presente
Pag. 36
7. Le entrate derivanti dall'applicazione delle sanzioni amministrative previste dall'articolo 18 affluiscono all'entrata del bilancio dello Stato per essere riassegnate allo stato di previsione del Ministero della salute e sono da questo destinate alla realizzazione delle finalità della presente legge.
Pag. 37
Allegato 1
(articolo 2, comma 2).
| Topo | Mus musculus
| Ratto
| Rattus norvegicus
| Porcellino d'India
| Cavia porcellus
| Mesocriceto dorato
| Mesocricetus auratus
| Coniglio
| Oryctolagus cuniculus
| Primati non umani
|
| Cane
| Canis familiaris
| Gatto
| Felis catus
| Quaglia
| Coturnix coturnix
| Gerbillo
| Unguiculatus Meriones
| Furetto
| Mustela Futorios F. Furo
| Minipig
|
| |
Pag. 38
Allegato 2
(articolo 12).
Ai sensi del presente Allegato si intende per:
a) «locali di permanenza»: i locali in cui gli animali vivono normalmente, sia a scopo di riproduzione e di allevamento, sia durante lo svolgimento delle procedure o delle tecniche;
b) «gabbia»: il contenitore fisso o mobile, recintato da muri, del quale almeno una parte è costituita da sbarre o da griglia metallica o, se necessario, da reti, e nel quale uno o più animali vengono tenuti o trasportati; in funzione del tasso di popolamento e delle dimensioni della gabbia, la libertà di movimento degli animali è più o meno limitata;
c) «box» chiuso: superficie racchiusa da mura, da sbarre o da griglia metallica nel quale sono tenuti uno o più animali; secondo le dimensioni del box e del tasso di popolamento, la libertà di movimento degli animali è in genere meno limitata che in una gabbia;
d) «paddock»: superficie recintata da staccionata, da mura, da sbarre o da griglia metallica, situato all'esterno di una costruzione, nel quale gli animali tenuti in gabbia o in recinto chiuso possono muoversi liberamente durante determinati periodi, conformemente ai loro bisogni etologici e fisiologici, ad esempio per fare del moto;
e) «box di stalla»: piccolo scompartimento a tre lati, generalmente dotato di mangiatoia e di tramezzi laterali, nel quale possono essere tenuti legati uno o due animali.
1. STRUTTURE
1.1. Funzione e progettazione generale.
1.1.1. Tutte le strutture devono essere progettate in modo da offrire un ambiente appropriato alle specie da ospitare. Devono inoltre essere studiate in modo da impedire l'accesso ai non addetti.
1.1.2. Anche le strutture che fanno parte di un edificio più importante devono essere protette da adeguate norme di costruzione e da disposizioni che limitano il numero delle entrate e impediscono la circolazione di persone non autorizzate.
1.1.3. Deve essere periodicamente effettuato un programma di manutenzione per evitare qualsiasi cedimento materiale.
Pag. 39
1.2. Locali di permanenza degli animali.
1.2.1. Si devono adottare tutte le misure necessarie per garantire una rapida ed efficiente pulizia dei locali e l'osservanza delle norme di igiene. I soffitti ed i muri devono essere resistenti e avere una superficie liscia, impermeabile e facilmente lavabile, facendo particolare attenzione alle giunture di porte, tubature e cavi. Qualora necessario, si può inserire nella porta uno spioncino per la visione. Il pavimento deve essere liscio, impermeabile, non scivoloso, facilmente lavabile, in grado di sopportare senza danni il peso dei compartimenti e di altre installazioni pesanti. Eventuali drenaggi di scolo devono essere correttamente coperti e muniti di griglia per impedire la penetrazione di animali.
1.2.2. I muri ed i pavimenti dei locali in cui gli animali possono muoversi liberamente devono essere rivestiti di materiale particolarmente resistente, atto a sopportare l'intenso logorio causato dagli animali e dalle pulizie. Il rivestimento deve essere innocuo per gli animali e tale da impedire che si feriscano. Nei locali è necessario installare drenaggi di scolo. È inoltre opportuna una protezione supplementare delle attrezzature e degli impianti affinché non vengano danneggiati dagli animali, né possano arrecare danno agli animali stessi. Nei recinti esterni si devono adottare le misure necessarie per impedire l'eventuale accesso del pubblico e di animali.
1.2.3. I locali destinati ad ospitare animali di allevamento (bovini, ovini, caprini, suini, pollame ed altri), devono rispettare almeno le norme stabilite dalla Convenzione europea sulla protezione degli animali negli allevamenti, adottata a Strasburgo il 10 marzo 1976, resa esecutiva dalla legge 14 ottobre 1985, n. 623, e quelle emanate dalle autorità nazionali veterinarie o altre norme vigenti in materia.
1.2.4. Non si possono far coabitare specie animali tra loro incompatibili.
1.2.5. I locali di permanenza degli animali devono essere dotati di impianti che consentono, ove occorra, di praticare manipolazioni o tecniche minori.
1.3. Laboratori e sale per procedure a finalità generale o specifica.
1.3.1. Le aziende di allevamento o le aziende fornitrici devono essere dotate di adeguati impianti per effettuare le consegne degli animali pronti per la spedizione.
1.3.2. Tutti gli istituti devono avere una dotazione minima di apparecchi di laboratorio per la diagnosi semplice, per gli esami post mortem e/o per raccogliere campioni ai fini di più approfonditi esami di laboratorio, da effettuare altrove.
1.3.3. Si devono adottare disposizioni per la ricezione degli animali in modo che il loro arrivo non metta in pericolo gli animali già presenti, prevedendo, ad esempio, un periodo di quarantena. Devono essere disponibili sale a scopo generale o specifico nei casi in cui non è opportuno condurre le procedure o le osservazioni nel medesimo locale di permanenza degli animali.
Pag. 40
1.3.4. È necessario disporre di locali separati per animali malati o feriti.
1.3.5. Se necessario, è opportuno disporre di una o più sale operatorie separate in modo da consentire la sepsi negli interventi chirurgici. È altresì opportuno disporre di locali per la convalescenza post-operatoria, qualora necessario.
1.4. Locali di servizio.
1.4.1. I locali in cui si conservano gli alimenti principali devono essere a bassa temperatura, asciutti e inaccessibili ai vermi e agli insetti; i locali adibiti a giacigli devono essere asciutti e inaccessibili ai vermi e agli insetti. I materiali che possono essere infetti, o comunque a rischio, devono essere conservati separatamente.
1.4.2. È necessario disporre di locali per deporre gabbie, strumenti e altri attrezzi, una volta ripuliti.
1.4.3. I locali da pulitura e da lavaggio devono essere sufficientemente spaziosi da contenere gli apparecchi per la disinfezione del materiale. Le operazioni di pulizia sono organizzate in modo da separare l'afflusso del materiale sporco da quello pulito per non infettare attrezzi appena lavati. Muri e pavimento sono ricoperti da un rivestimento adeguatamente resistente e l'impianto di ventilazione è sufficientemente potente da eliminare calore e umidità eccessivi.
1.4.4. Si devono adottare disposizioni per l'igiene del magazzinaggio e delle operazioni di eliminazione delle carcasse e degli altri scarti animali. Se non è possibile, né opportuno, l'incenerimento sul posto, occorre adottare adeguate disposizioni per eliminare tali sostanze conformemente ai regolamenti ed ai decreti locali. Si devono adottare precauzioni speciali in caso di rifiuti altamente tossici o radioattivi.
1.4.5. La progettazione e la costruzione delle aree di circolazione devono essere conformi alle norme relative alla permanenza degli animali. I corridoi devono essere sufficientemente larghi per l'agevole circolazione del materiale mobile.
2. AMBIENTE NEI LOCALI DI PERMANENZA DEGLI ANIMALI E SUO CONTROLLO
2.1. Ventilazione.
2.1.1. I locali di permanenza degli animali sono muniti di un sistema di ventilazione adeguato alle esigenze delle specie ospitate. Scopo della ventilazione è introdurre aria pura e ridurre gli odori, i gas tossici, la polvere e ogni tipo di agente infettivo, nonché eliminare l'eccesso di calore e di umidità.
2.1.2. L'aria nei locali va frequentemente rinnovata. In genere è sufficiente un tasso di ventilazione di 15-20 ricambi d'aria/ora. Nondimeno, in talune circostanze, quando il popolamento è scarso, può essere sufficiente un tasso di ventilazione di 8-10 ricambi d'aria/ora e una ventilazione meccanica può perfino risultare superflua.
Pag. 41
2.1.3. L'impianto di ventilazione deve essere progettato in modo da evitare correnti d'aria nocive.
2.1.4. È vietato fumare nei locali di permanenza degli animali.
2.2. Temperatura.
2.2.1. Nella tabella 1 figura la gamma di temperature raccomandate: le cifre riguardano soltanto gli animali adulti e normali. I neonati ed i piccoli richiedono sovente una temperatura più elevata. Nel regolare la temperatura dei locali si deve tenere conto delle eventuali modifiche della termoregolazione degli animali, dovute a particolari condizioni fisiologiche e agli effetti delle temperature di ricerca.
2.2.2. È necessario un impianto di ventilazione con dispositivo di riscaldamento e di raffreddamento dell'aria.
2.2.3. Negli istituti utenti, la temperatura dei locali di permanenza degli animali va controllata con precisione, essendo la temperatura ambiente un fattore fisico che esercita un importante effetto sul metabolismo di tutti gli animali.
2.3. Umidità.
Le variazioni estreme dell'umidità relativa (UR) esercitano un effetto dannoso sulla salute e sul benessere degli animali. Si raccomanda quindi che il grado di UR nei locali sia adeguato alle specie ospitate, e in genere mantenuto a 55 per cento - 10 per cento. È opportuno evitare per un periodo prolungato valori inferiori al 40 per cento o superiori al 70 per cento di UR.
2.4. Illuminazione.
Nei locali sprovvisti di finestre, occorre fornire un'illuminazione artificiale controllata, sia per rispettare le esigenze biologiche degli animali, sia per fornire un soddisfacente ambiente di lavoro. È parimenti necessario controllare l'intensità luminosa e il ciclo luce-buio. Per gli animali albini si deve tenere conto della loro sensibilità alla luce.
2.5. Rumore.
Il rumore può costituire un importante fattore di disturbo per gli animali. I locali di permanenza e le sale devono essere isolati contro qualsiasi fonte di intenso rumore nella gamma dei suoni udibili e dei suoni a più alta frequenza, per evitare disturbi del comportamento e della fisiologia degli animali. Rumori improvvisi possono determinare importanti modifiche delle funzioni organiche ma, essendo taluni
Pag. 42
2.6. Impianto di allarme.
Una struttura che ospita numerosi animali è vulnerabile. È necessario quindi proteggere correttamente le strutture mediante impianti che segnalino gli incidenti e l'intrusione di persone non autorizzate. I difetti tecnici o i guasti dell'impianto di ventilazione costituiscono un altro pericolo di disordini e anche di morte degli animali per soffocamento o per eccesso di calore, oppure, nei casi meno gravi, potrebbero esercitare su una procedura effetti negativi al punto di vanificarla e doverla quindi ripetere. È pertanto opportuno installare adeguati dispositivi di controllo nell'impianto di riscaldamento e di ventilazione affinché il personale possa sorvegliarne il funzionamento globale. Se necessario, è opportuno installare un gruppo elettrogeno di soccorso, per garantire il funzionamento degli apparecchi necessari alla sopravvivenza degli animali e all'illuminazione in caso di guasto o di interruzione della fornitura di elettricità. È necessario affiggere bene in vista chiare disposizioni per i casi di emergenza. È obbligatorio un impianto di allarme nelle vasche dei pesci per il caso di interruzione del rifornimento d'acqua. Occorre vigilare affinché il funzionamento dell'impianto di allarme disturbi il meno possibile gli animali.
3. TUTELA
3.1. Salute.
3.1.1. La persona responsabile dell'istituto deve assicurarsi che un veterinario esegua regolari ispezioni degli animali e delle condizioni in cui sono alloggiati e curati.
3.1.2. Dato il potenziale rischio che rappresentano per gli animali la salute e l'igiene del personale, quest'ultimo deve essere oggetto di particolare attenzione.
3.2. Condizioni di imballo e di trasporto.
Ogni trasporto costituisce per gli animali uno stress, da alleviare il più possibile. Ai fini del trasporto, gli animali devono essere sani e lo speditore è tenuto a controllare che lo siano effettivamente. Animali malati o comunque non idonei fisicamente non devono mai essere trasportati, salvo che per ragioni terapeutiche o diagnostiche. Occorre dare particolare attenzione alle femmine in stato di avanzata gravidanza. Le femmine che potrebbero partorire durante il percorso, o quelle che hanno partorito nelle precedenti quarantotto ore e la loro prole, non possono essere trasportate. Lo speditore e il trasportatore
Pag. 43
3.3. Ricezione ed apertura dei colli.
I colli contenenti animali devono essere ritirati ed aperti senza inutili ritardi. Ad avvenuta ispezione, gli animali sono trasferiti in gabbie pulite o in box puliti, e adeguatamente nutriti e dissetati. Gli animali malati o comunque non idonei fisicamente devono essere tenuti in osservazione, separati dagli altri. Sono esaminati tempestivamente da un veterinario e curati. Gli animali che non presentano alcuna possibilità di guarigione devono essere immediatamente soppressi con metodo indolore. I contenitori che sono serviti per il trasporto devono essere immediatamente distrutti, qualora non sia possibile disinfettarli.
3.4. Quarantena, isolamento ed acclimatazione.
3.4.1. Gli scopi della quarantena sono:
a) proteggere gli altri animali ospitati;
b) proteggere l'uomo da infezioni zoonotiche;
c) promuovere una buona prassi scientifica.
A meno che la salute degli animali introdotti in uno stabilimento di allevamento sia soddisfacente, si raccomanda di metterli in quarantena. In taluni casi, ad esempio per la rabbia, questo periodo è fissato dalla legislazione nazionale. In altri casi può variare o deve essere determinato in funzione delle circostanze dal veterinario dello stabilimento (vedi anche tabella 2).
Gli animali possono essere utilizzati per procedure o tecniche durante la quarantena qualora si siano acclimatati al nuovo ambiente e non presentino alcun importante rischio per altri animali o per l'uomo.
3.4.2. Si raccomanda di predisporre locali per isolare gli animali che presentano sintomi di cattiva salute o siano sospetti di essere ammalati, così da costituire un rischio per l'uomo o per altri animali.
Pag. 44
3.4.3. Anche se si fosse constatato che gli animali sono sani, è buona prassi zootecnica imporre loro un periodo di acclimatazione, prima di utilizzarli in procedure o tecniche, la cui durata dipende da vari fattori, quali la durata del trasporto e l'età dell'animale. La durata di tale periodo è decisa dal veterinario.
3.5. Ingabbiamento.
3.5.1. Si possono distinguere due principali modi di ospitare gli animali:
a) il modo seguito nelle aziende di allevamento, nelle aziende di fornitura e negli istituti utenti del ramo biomedico, consistente nell'ospitare roditori, conigli, carnivori, uccelli e primati animali, talvolta anche ruminanti, suini ed equini. Le disposizioni relative a gabbie, box chiusi, paddock e box di stalla adatti a queste strutture figurano nelle tabelle da 3 a 13. Altre indicazioni relative alla superficie minima del pavimento delle gabbie figurano nei diagrammi da 1 a 7. Inoltre, adeguati orientamenti per valutare la densità di popolamento nelle gabbie figurano nei diagrammi da 8 a 12;
b) il modo sovente seguito nei laboratori che eseguono procedure o tecniche unicamente su animali da fattoria o su animali di analoghe dimensioni. Le attrezzature di tali laboratori non devono essere inferiori a quelle imposte dalle vigenti norme veterinarie.
3.5.2. Le gabbie ed i box chiusi non devono essere fabbricati con materiale nocivo agli animali. Devono essere studiati in modo da impedire agli animali di ferirsi e, se non eliminabili dopo l'uso, essere costruiti con materiale resistente, adatto alle tecniche di pulizia e di disinfezione. È necessario progettare con particolare attenzione il pavimento delle gabbie e dei box chiusi, che deve variare secondo la specie e l'età degli animali ed essere studiato in modo da poter rimuovere agevolmente gli escrementi.
3.5.3. I box chiusi sono progettati tenendo presente il benessere delle specie da ospitare. Essi devono consentire la soddisfazione di taluni bisogni etologici (arrampicarsi, isolarsi o ripararsi temporaneamente, eccetera), nonché un'accurata pulitura e la possibilità di evitare il contatto con altri animali.
3.6. Alimentazione.
3.6.1. Nelle operazioni di scelta, produzione e preparazione dell'alimento per animali, si devono adottare precauzioni per evitare qualsiasi infezione di origine chimica, fisica e microbiologica. L'alimento deve essere imballato in sacchi chiusi, impermeabili, recanti, se possibile, la data di preparazione. L'imballo, il trasporto ed il magazzinaggio sono studiati in modo da evitare la contaminazione, il deterioramento o la distruzione. I depositi devono essere a bassa temperatura, oscuri, asciutti, inaccessibili a vermi e insetti. Gli alimenti rapidamente deperibili, quali foraggio verde, verdure, carni,
Pag. 45
3.6.2. Tutte le mangiatoie, tutti gli abbeveratoi od altri attrezzi utilizzati per l'alimentazione degli animali devono essere regolarmente ripuliti e, se necessario, sterilizzati. Se si usano mangimi umidi o se i mangimi sono facilmente contaminabili con acqua, urine, eccetera, è necessario procedere a pulizia quotidiana.
3.6.3. La somministrazione degli alimenti varia secondo la specie e deve soddisfare i bisogni fisiologici dell'animale. Ogni animale deve essere messo nelle condizioni di poter accedere al mangime.
3.7. Acqua.
3.7.1. Tutti gli animali devono disporre in permanenza di acqua potabile non infetta. Durante il trasporto, è accettabile che l'acqua venga somministrata quale parte di alimentazione umida. D'altro canto, l'acqua è un veicolo di microrganismi e va somministrata in modo da ridurre al minimo i rischi. Si seguono correttamente due metodi: le bottiglie biberon e gli apparecchi per l'abbeveraggio automatico.
3.7.2. Per animali piccoli, quali i roditori ed i conigli, si ricorre sovente alla bottiglia. Questi recipienti devono essere in materiale translucido per controllarne il contenuto. Il collo della bottiglia deve essere sufficientemente largo per poter agevolmente ripulirla a fondo; le bottiglie in materia plastica non devono lasciar fuoriuscire il liquido. Anche le capsule, i tappi e i tubi devono essere sterilizzati e di facile ripulitura. Tutte le bottiglie e tutti gli accessori vanno smontati, ripuliti e sterilizzati ad adeguati e regolari intervalli. È preferibile sostituire ogni volta le bottiglie con altre pulite e sterilizzate, invece di riempirle nei locali di permanenza degli animali.
3.7.3. Gli abbeveratoi automatici devono essere regolarmente verificati e risciacquati e se ne deve controllare regolarmente il funzionamento per evitare incidenti e l'insorgere di infezioni. Se si usano gabbie a fondo compatto, occorre cercare di ridurre al minimo il rischio di allagamenti. È inoltre necessario procedere regolarmente ad un esame batteriologico dell'apparecchio per tenere sotto controllo la qualità dell'acqua.
3.7.4. L'acqua proveniente dalle canalizzazioni pubbliche contiene alcuni microrganismi considerati in genere non pericolosi, a meno che si lavori con animali definiti microbiologicamente. In tali casi l'acqua deve essere trattata. L'acqua delle canalizzazioni pubbliche è in genere clorata, per evitare il moltiplicarsi di microrganismi. Questa clorazione non sempre riesce a limitare lo sviluppo di taluni germi patogeni potenziali, quali ad esempio gli pseudomonas. Una precauzione supplementare può consistere nell'aumentare il tasso di cloro nell'acqua, o nell'acidificare l'acqua per ottenere l'effetto voluto.
3.7.5. I pesci, gli anfibi e i rettili presentano una tolleranza molto varia da specie a specie, nei confronti dell'acidità, del cloro e di altri prodotti chimici. Per tali ragioni occorre adottare disposizioni per rifornire agli acquari e ai vivai l'acqua proporzionata al fabbisogno e alla soglia di tolleranza delle singole specie.
Pag. 46
|
Primati del Nuovo mondo, non umani
| |
| Topo
| |
| Ratto
| |
| Criceto siriano
| |
| Gerbillo
| |
| Porcellino d'India
| |
| Primati del Vecchio mondo, non umani
| |
| Quaglia
| |
| Coniglio
| |
| Gatto
| |
| Cane
| |
| Furetto
| |
| Polli
| |
| Piccione
| |
| Maiale
| |
| Capra
| |
| Ovino
| |
| Bovino
| |
| Cavallo
| |
Nota: In casi particolari, ad esempio quando si alloggiano animali molto giovani o glabri, possono essere necessarie temperature ambiente più elevate di quelle indicate nella presente tabella.
| | |
|
Topo | |
| Ratto | |
| Gerbillo | |
| Criceto siriano | |
| Porcellino d'India | |
| Coniglio | |
| Gatto | |
| Cane | |
| Primate animale | |
Pag. 47
| | | |
| Topo |
| |
|
Ratto |
|
|
|
Criceto siriano |
|
|
|
Porcellino d'India |
|
|
|
Coniglio 1 kg |
|
|
|
Coniglio 2 kg |
|
|
|
Coniglio 3 kg |
|
|
|
Coniglio 4 kg |
|
|
|
Coniglio 5 kg |
|
|
Nota: Per «altezza della gabbia» si intende la distanza verticale tra il pavimento della gabbia e la parte superiore orizzontale del coperchio o della gabbia.
Nel progettare le ricerche si deve tenere conto del potenziale di crescita degli animali per assicurare loro un adeguato spazio conformemente alla presente tabella, durante tutte le fasi delle procedure.
Vedi anche diagrammi da 1 a 5 e da 8 a 12.
| | | |
|
Topo |
|
|
|
Ratto |
|
|
|
Criceto siriano |
|
|
|
Porcellino d'India |
|
|
|
Porcellino d'India in hrem |
|
|
Nota: Per la definizione «altezza della gabbia», vedi nota tabella 3.
Pag. 48
| | | | |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Nota: Per la definizione di «altezza della gabbia», vedi nota tabella 3.
La superficie minima del pavimento della gabbia per una coniglia e sua prole comprende la superficie del pavimento dello scomparto per il giaciglio.
Vedi diagramma 6.
| | | | | |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Nota: La permanenza dei gatti nelle gabbie deve essere rigorosamente limitata. I gatti così confinati devono uscire e fare del moto almeno una volta al giorno, qualora ciò non interferisca con le finalità del progetto. I recinti per gatti devono essere muniti di contenitori per escrementi e di un'ampia superficie di riposo, nonché di oggetti per arrampicarsi e per limare gli artigli.
Per «altezza della gabbia» si intende la distanza verticale tra il punto più elevato del pavimento della gabbia e il punto più basso del soffitto della gabbia.
Nel calcolo della superficie minima del pavimento è possibile includere la superficie dei piani da riposo. La superficie minima del pavimento per una gatta e sua prole comprende la superficie di 0,18 m2 dello scomparto per figliare.
Vedi anche diagramma 7.
Pag. 49
| | | |
|
|
|
|
|
|
|
|
|
|
|
|
Nota: I cani non devono rimanere in gabbia più a lungo di quanto necessario ai fini della procedura. I cani in gabbia devono poter uscire per fare moto almeno una volta al giorno qualora ciò non sia incompatibile con le finalità del progetto. Si deve fissare un termine al di là del quale un animale non può rimanere in gabbia senza moto quotidiano. Le superfici per il moto devono essere sufficientemente vaste affinché i cani possano muoversi liberamente. Non si possono utilizzare pavimenti a griglia nelle gabbie per cani se non qualora sia necessario al progetto. Date le grandi differenze di altezza e data la limitata interdipendenza tra misura e peso delle varie razze di cani, l'altezza della gabbia deve essere stabilita in funzione dell'altezza del corpo dei singoli animali, misurando a partire dall'altezza delle spalle. Come norma generale l'altezza minima della gabbia deve essere due volte quella misurata dall'altezza delle spalle.
Per la definizione di «altezza della gabbia», vedi nota tabella 6.
| | | | |
| | | ||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Nota: Le cifre fra parentesi indicano la superficie totale, ossia la superficie del pavimento del recinto chiuso, più la superficie adiacente per il moto. I cani tenuti a lungo nei recinti esterni devono poter accedere ad un luogo riparato, per proteggersi dal maltempo. Quando i cani sono alloggiati su superfici a griglia, si deve fornire loro una superficie piatta per dormire. Non si possono utilizzare pavimenti a griglia se non nei casi richiesti dal progetto. I tramezzi che separano i recinti chiusi devono essere fatti in modo da evitare che i cani si feriscano l'un l'altro. Tutti i recinti chiusi dispongono di adeguato drenaggio.
Pag. 50
Nota introduttiva: Data l'enorme varietà delle misure e delle caratteristiche dei primati, è particolarmente importante far concordare la struttura, le attrezzature interne e le dimensioni delle gabbie ai bisogni specifici dei primati. Per questi ultimi, il volume complessivo della gabbia è tanto importante quanto la superficie minima del pavimento. Come norma generale, l'altezza della gabbia, almeno per le scimmie antropoidi e altre scimmie, deve essere la dimensione più grande. L'altezza minima della gabbia deve consentire agli animali di tenersi eretti. L'altezza minima della gabbia per i primati deve consentire a questi animali di dondolarsi in estensione totale a partire dal soffitto, senza che i piedi tocchino il pavimento della gabbia. Se necessario si devono installare dei posatoi per permettere agli animali di utilizzare la parte superiore della gabbia.
È possibile alloggiare in una gabbia due primati che vanno d'accordo. Quando i primati non possono essere alloggiati a due, le gabbie devono essere disposte in modo che i primati possano vedersi ma anche, se necessario, non vedersi.
Tenendo presente quanto sopra, la presente tabella indica i parametri minimi per la permanenza in gabbia di gruppi delle specie più comunemente utilizzate (super famiglie Ceboidea e Cercopithecoidea).
| | | |
|
|
|
|
| | | |
| | | |
| | | |
| | | |
| | | |
| | | |
Nota: Per la definizione di «altezza della gabbia», vedi nota tabella 6.
| | | |
|
|
|
|
| | | |
| | | |
Nota: La tabella si applica anche ai suinetti. I suini non vanno tenuti in gabbia, tranne in caso di assoluta necessità allo scopo del progetto e anche in tale caso soltanto per un periodo minimo.
Per la definizione di «altezza della gabbia», vedi nota tabella 6.
Pag. 51
| | | | | | |
|
Suini 10-30
30-50 50-100 100-150 150 | 2 3 5 5 | 1,8 2,1 2,5 2,5 | 1,0 1,2 1,4 1,4 | 0,3 0,8 1,2 2,5 | 0,25 0,30 0,35 0,40 |
| Ovini 70
| | | | | |
| Caprini 70
| | | | | |
| Bovini 60
60-100 100-150 150-200 200-400 400 | 2,2 2,4 2,5 2,6 2,8 | 1,8 1,8 2,0 2,2 2,2 | 1,0 1,0 1,2 1,4 1,4 | 1,0 1,2 1,4 1,6 1,8 | 0,30 0,35 0,40 0,55 0,65 |
| Equini adulti
| | | | | |
| | | | |
| Suini 100-150
150 | 2,5 | 2,5 | 1,4 |
| Ovini 70
| | | |
| Caprini 70
| | | |
| Bovini 60-100
100-150 150-200 200-350 350-500 500 | 0,9 1,2 1,8 2,1 2,6 | 1,4 1,6 1,8 1,9 2,2 | 0,9 1,4 1,4 1,4 1,4 |
| Equini adulti
| | | |
Nota: I box di stalla devono essere sufficientemente ampi in modo che gli animali possano distendersi comodamente.
Pag. 52
| | | | | | |
| Polli 100-300
300-600 600-1.200 1.200-1.800 1.800-2.400 (Maschiadulti)2.400 | 500 1.000 1.200 1.400 1.800 | 400 600 700 800 1.200 | 300 450 550 650 1.000 | 35 45 45 45 60 | 7 10 12 12 15 |
| Quaglie 120-140
| | | | | |
Nota: Per «superficie» si intende il prodotto della larghezza della gabbia misurata dall'interno, orizzontalmente, non il prodotto della lunghezza e della larghezza del suolo della gabbia.
Per la definizione di «altezza della gabbia», vedi nota tabella 6.
La larghezza delle maglie nei pavimenti a griglia non deve superare 10x10 mm per i pulcini e 25x25 mm per i volatili giovani adulti. Il diametro del filo di ferro non deve essere inferiore a 2 mm. L'inclinazione del suolo non deve superare il 14% (8o).
Gli abbeveratoi devono essere lunghi quanto le mangiatoie. Quando si utilizzano biberon o tazze, ogni uccello deve avere accesso a due biberon o a due tazze. Le gabbie devono essere dotate di posatoi affinché gli uccelli posti in gabbie separate possano vedersi.
Pag. 53

Pag. 54
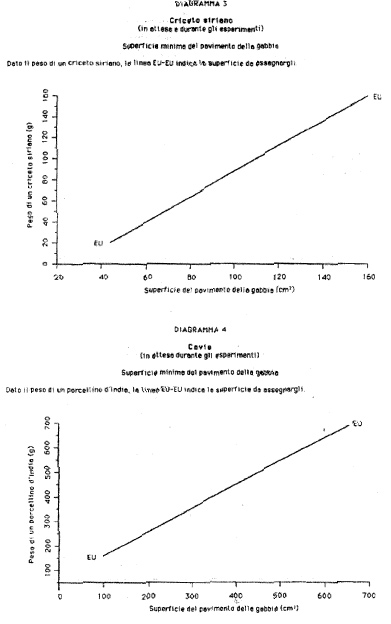
Pag. 55

Pag. 56

Pag. 57
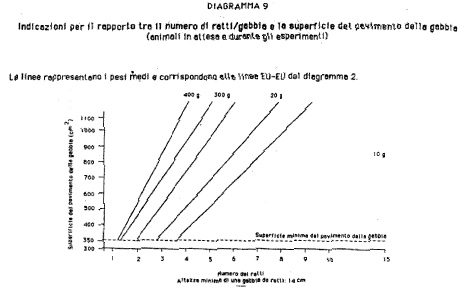
Pag. 58

Pag. 59
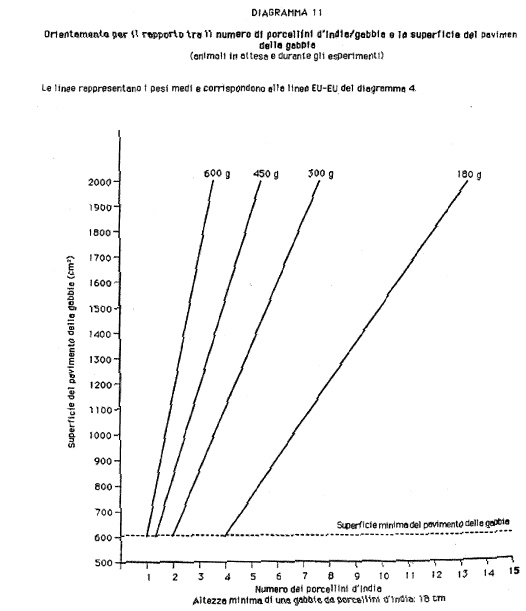
Pag. 60

Pag. 61
Allegato 3
(articolo 10, comma 2)
1) Domanda in bollo da 10,33 euro (salvo i casi di esenzione dall'imposta previsti a norma di legge).
2) Documentazione attestante la qualificazione professionale del responsabile tecnico dello stabilimento utilizzatore e del personale adibito alla assistenza agli animali e al funzionamento delle attrezzature.
3) Dichiarazione di accettazione dell'incarico del responsabile con firma autenticata.
4) Relazione tecnico-scientifica indicante la tipologia dei progetti e le specie animali impiegate.
5) Foglio-tipo del registro su cui vengono annotati i movimenti degli animali utilizzati in tecniche o procedure.
6) Originale della ricevuta del bollettino di versamento di 774,69 euro sul c/c n. 11281011 intestato al Ministero della salute - Dipartimento della prevenzione e della comunicazione - Direzione generale della sanità veterinaria e degli alimenti - ufficio X, ai sensi di quanto previsto dal decreto del Ministro della sanità 14 febbraio 1991, pubblicato nel supplemento ordinario alla Gazzetta Ufficiale n. 63 del 15 marzo 1991, e successive modificazioni, utilizzando l'apposito modello Ch8 quater AOT e specificando sul retro le casuali del versamento.
7) Numero 2 marche da bollo (valore riferito al momento di presentazione della domanda) salvo i casi di esenzione dall'imposta di bollo previsti a norma di legge.
8) Pianta/e dello stabulario/i e/o dei locali dove vengono tenuti gli animali prima, durante e dopo l'esecuzione del progetto.
9) Elenco delle attrezzature presenti.
10) Parere igienico-sanitario rilasciato dalla ASL competente territorialmente.
Pag. 62
Allegato 4
(articolo 14)
* NON INSERIRE IN QUESTO MODULO INFORMAZIONI DI PROPRIETÀ RISERVATA
SEZIONE 1: INFORMAZIONI RELATIVE AL DICHIARANTE
Responsabile del progetto
Cognome
Nome
Codice fiscale
Titolo di studio (e posizione accademica qualora applicabile)
Dipartimento o istituto di afferenza
Indirizzo
SEZIONE 2: INFORMAZIONI RELATIVE AL PROGETTO
NUOVO ( )
TIPO REGOLATORIO( )
RICERCA DI BASE( )
ALTRO ( )
RINNOVO ( )
Se richiesta di rinnovo, specificare la motivazione
Pag. 63
SEZIONE 3: STABILIMENTO UTILIZZATORE
Denominazione
Ubicazione
Estremi dell'autorizzazione rilasciata ai sensi dell'articolo 12
Responsabile dello stabilimento utilizzatore:
Cognome
Nome
Titolo di studio
Dipartimento o istituto di afferenza
Indirizzo
SEZIONE 4: PROGETTO
1. Titolo del progetto
2. Obiettivi del progetto
(Descrivere gli obiettivi della ricerca proposta. Specificare l'importanza per la salute dell'uomo o degli animali o per il progresso scientifico o tecnologico)
3. Utilizzo degli animali
(spiegare perché per questo progetto è necessario ricorrere all'uso degli animali)
4. Impiego di metodi alternativi
(spiegare come nella pianificazione del progetto sono stati affrontati e applicati metodi alternativi)
a. Riduzione (riducendo il numero di animali usati)
b. Sostituzione (sostituendo modelli animali con modelli in vitro)
c. Affinamento (sostituendo tecniche invasive con modelli meno invasivi)
Pag. 64
5. Il progetto duplica altri progetti
SI [ ] NO [ ]
Se SI, motivare la necessità della duplicazione
6. Durata del progetto (soltanto della parte in vitro massimo tre anni)
SEZIONE 5: ANIMALI
1. Specie di animali da utilizzare
[ ] Gatti
[ ] Cavalli
[ ] Primati non umani
[ ] Topo
[ ] Ratto
[ ] Coniglio
[ ] Altro (specificare)
Numero totale di animali/specie previsti per anno*
* è possibile fornire i range.
Fornitori degli animali/specie:
2. Fornire giustificazione scientifica e/o regolatoria per l'utilizzo delle specie al punto 1
3. Giustificare il numero di animali utilizzati nel progetto.
4. Qualora il numero di animali proposti sia il minimo richiesto per ottenere dei dati significativi, indicare se ciò si basa su:
dati storici di supporto
letteratura pubblicata
criteri statistici
Pag. 65
SEZIONE 6: PROCEDURE
Responsabile/i dell'esecuzione delle procedure
Cognome
Nome
Codice fiscale
Titolo di studio (e posizione accademica qualora applicabile)
Dipartimento o istituto di afferenza
Indirizzo
1. Descrivere sommariamente le procedure eseguite sugli animali specificando, ove possibile:
a) i materiali e le tecniche, inerenti esclusivamente al progetto, che ci si propone di utilizzare
b) la tempistica per l'osservazione degli animali nel corso e a seguito delle procedure
c) le misure che saranno adottate nel caso in cui si verifichino reazioni avverse
2. Gli animali saranno utilizzati in più di una procedura
SI ______________
NO ______________
Se SI, compilare i punti seguenti:
a) Quale sarà la durata dei periodi di riposo tra le procedure?
b) Quante procedure saranno condotte su un singolo animale?
3. Gli animali saranno utilizzati in più di una procedura ai sensi del comma 11 dell'articolo 4
SI ______________
NO ______________
4. Gli animali saranno coinvolti contemporaneamente in altri progetti?
SI ______________
NO ______________
Se SI, fornire informazioni più dettagliate.
(Sono esclusi dalla compilazione dei punti 2, 3 e 4 i progetti di tipo regolatorio).
Pag. 66
SEZIONE 7: ANIMALI GENETICAMENTE MODIFICATI
Il progetto prevede:
Generazione di animali GM [ ] vai a capo 1
Produzione di animali GM [ ] vai a capo 2
Utilizzo di animali GM [ ] vai a capo 3
Capo 1. GENERAZIONE
1. Animale
2. È stato consultato un data base internazionale?
SI [ ] NO [ ]
3. Specificare il tipo di mutazione che si vuole indurre e con quale tecnica
4. Descrivere brevemente il fenotipo atteso
5. Specificare il tipo di prelievo utilizzato per analizzare l'espressione genica nella progenie:
(*) fornire giustificazione
6. Numero di animali che verranno utilizzati come colonie di supporto:
Vasectomizzati No
Maschi fertili No
Femmine donatrici No
Femmine accettrici No
7. Come saranno identificati gli animali?
Pag. 67
8. Indicare il numero di animali eccedenti previsto e se questi verranno riutilizzati o sacrificati.
9. Nel caso in cui si ottenga una linea verrà effettuato uno studio pilota per valutare il benessere degli animali e la validità scientifica del modello?
SI [ ] NO [ ]
10. Descrivere come saranno monitorati gli animali e quali criteri oggettivi saranno usati per determinare se un animale debba essere rimosso dal progetto prematuramente.
11. Se è richiesto un livello di contenimento, illustrare il motivo, descrivere le procedure di contenimento e, in caso di rilascio accidentale, i potenziali rischi per la salute umana, per gli animali e per l'ambiente.
12. Verranno congelati gli embrioni?
SI [ ] NO [ ]
13. In caso di mutanti sofferenti quali strategie verranno utilizzate per ridurre al minimo la sofferenza?
14. Descrivere i potenziali vantaggi che il modello GM offre rispetto ad altri modelli e come il ricorso a questo modello contribuisce al principio cosiddetto «delle 3R».
15. I dati relativi al nuovo modello saranno pubblicati su data base internazionali?
Nota: La generazione di un nuovo mutante ricade in un livello di sofferenza 3.
Dopo 1 anno il ricercatore dovrà produrre una relazione e nel caso in cui il mutante generato non mostri fenotipo sofferente il livello di sofferenza verrà rivalutato.
Pag. 68
Capo 2. PRODUZIONE (Allevamento)
1. Specie:
2. Origine degli animali e condizioni di trasporto.
3. Background genetico (in caso di roditori).
4. Qualità microbiologica degli animali: S.P.F. [ ] Convenzionali [ ]
5. Qualità genetica degli animali in riproduzione:
[ ] Eterozigoti
[ ] Omozigoti
[ ] Per la mutazione
6. Se eterozigoti, specificare il tipo di prelievo utilizzato per analizzare l'espressione genica della progenie:
(*) fornire giustificazione
7. Come saranno identificati gli animali?
8. Fenotipo
[ ] Normale
[ ] Sofferente Classe di sofferenza: 1[ ] 2[ ] 3[ ] Non conosciuta [ ]
(Indicare se uno studio pilota ha già fornito indicazioni circa il fenotipo mostrato, il benessere degli animali e la qualità scientifica del modello).
9. In caso di fenotipo sofferente elencare le strategie per limitare la sofferenza e se tali informazioni sono già disponibili.
Pag. 69
10. Indicare orientativamente il numero (ed il tipo) di animali che saranno allevati ed il loro patrimonio genetico.
11. Specificare il destino degli animali eccedenti.
12. Descrivere come saranno monitorati gli animali e quali criteri oggettivi saranno usati per determinare se un animale debba essere rimosso dalla produzione prematuramente.
13. Se è richiesto un livello di contenimento, illustrare il motivo, descrivere le procedure di contenimento e, in caso di rilascio accidentale, i potenziali rischi per la salute umana, per gli animali e per l'ambiente.
14. I dati relativi agli animali saranno pubblicati su data base internazionali?
SI [ ]
NO [ ]
Capo 3. UTILIZZO
1. Specie.
2. Origine degli animali e condizioni di trasporto.
3. Background genetico (in caso di roditori).
4. Qualità microbiologica degli animali: S.P.F. [ ] Convenzionali [ ]
Pag. 70
5. Fenotipo sofferente:
[ ] Normale
[ ] Sofferente Classe di sofferenza [ ]
Descrizione del fenotipo sofferente:
6. In caso di fenotipo sofferente elencare le strategie per limitare la sofferenza e se tali informazioni sono già disponibili.
7. Gli animali sono:
[ ] eterozigoti
[ ] omozigoti
[ ] per la mutazione
8. Come saranno identificati gli animali?
9. Numero di animali che saranno utilizzati.
10. Specificare particolari condizioni di stabulazione o di necessità di trattamento.
11. Se è richiesto un livello di contenimento, illustrare il motivo, descrivere le procedure di contenimento e, in caso di rilascio accidentale, i potenziali rischi per la salute umana, per gli animali e per l'ambiente.
12. Descrivere i vantaggi che il modello GM offre rispetto ad altri modelli e come il ricorso a questo modello contribuisce al principio «delle 3R».
Pag. 71
SEZIONE 8: LIVELLI DI SOFFERENZA
INDICAZIONI CIRCA LA CORRETTA CLASSIFICAZIONE DEI LIVELLI DI SOFFERENZA A CUI SI PRESUME ANDRANNO INCONTRO GLI ANIMALI.
IN ASSENZA DI CONSIDERAZIONI SPECIE-SPECIFICHE CHE LO CONTRADDICONO, VALE IL PRINCIPIO CHE IL LIVELLO DI SOFFERENZA SPERIMENTATO DALL'ANIMALE SIA PARAGONABILE AL LIVELLO DI SOFFERENZA SPERIMENTATO DA UN ESSERE UMANO SOTTOPOSTO ALLA STESSA PROCEDURA.
1. Indicare i punti che trovano applicazione.
(N.B. 0 + 1 + 2 + 3 = 100%) % Animali
CLASSE 0: Procedure o tecniche che provocano un livello di dolore o sofferenza non superiore a quello prodotto da iniezioni di routine o venipunture (esclusi i trattamenti intratoracici o intracardiaci).
Procedure o interventi chirurgici condotti sotto anestesia terminale.
Interventi chirurgici sotto anestesia generale.
| | | |
| Classe 1. []
Procedure che possono causare disagio o dolore di bassa/media intensità per brevi periodi di tempo |
[] Bassa [] Media |
[] Breve |
| Classe 2. []
Procedure che possono causare disagio o dolore di bassa/media intensità per periodi di tempo intermedi ovvero di intensità elevata per periodi di tempo brevi |
[] Bassa [] Media
[] Elevata |
[] Intermedia
[] Breve |
| Classe 3. []
Procedure che possono causare disagio o dolore di bassa/media intensità per periodi di tempo prolungati ovvero di intensità elevata per periodi di tempo intermedi o prolungati |
|
[] Intermedia [] Prolungata |
Pag. 72
SEZIONE 9: ANESTETICI, ANALGESICI, ANSIOLITICI
OVE IL PROGETTO INCLUDA L'USO DI ANESTETICI, ANALGESICI O ANSIOLITICI, COMPILARE LA SEZIONE SEGUENTE:
1. Indicare la somministrazione di anestetici, analgesici e/o ansiolitici in riferimento alle classi di sofferenza:
CLASSE 1. SI [ ] NO [ ] N. di animali/range [ ]
CLASSE 2. SI [ ] NO [ ] N. di animali/range [ ]
CLASSE 3. SI [ ] NO [ ] N. di animali/range [ ]
2. Qualora si intendano effettuare procedure che possono causare livelli di sofferenza di classe 1, 2 o 3, senza la somministrazione di anestetici e/o analgesici, fornire la giustificazione scientifica e le assicurazioni che la procedura dolorosa continuerà soltanto per il periodo di tempo minimo necessario.
3. Elencare gli agenti antidolorifici, anestetici, analgesici che verranno utilizzati per ogni procedura:
| | | |
|
|
|
|
|
|
| | |
SEZIONE 10: RESTRIZIONI FISICHE
OVE GLI ANIMALI VENISSERO IMMOBILIZZATI PER UN PERIODO SUPERIORE AD UN'ORA COMPLETARE LA SEZIONE SEGUENTE.
1. Motivare l'uso della immobilizzazione.
2. Descrivere il dispositivo di immobilizzazione.
Pag. 73
3. Indicare la durata e la frequenza della immobilizzazione e la durata dei periodi di riposo tra i periodi di restrizione.
4. Descrivere gli eventuali metodi di pre-condizionamento utilizzati.
5. Elencare le procedure eseguite nel corso del periodo di immobilizzazione.
6. Elencare i criteri utilizzati per valutare il benessere degli animali nel corso del periodo di immobilizzazione.
7. Durante la immobilizzazione degli animali saranno utilizzati farmaci antidolorifici e/o ansiolitici?
SEZIONE 11: INTERVENTI CHIRURGICI
OVE IL PROGETTO INCLUDESSE INTERVENTI CHIRURGICI, COMPLETARE LA SEZIONE SEGUENTE.
1. Gli animali saranno sottoposti a:
[ ] Chirurgia che non prevede la sopravvivenza: gli animali saranno sottoposti ad eutanasia prima della ripresa dall'anestesia.
[ ] Chirurgia che prevede la sopravvivenza: completare i punti a) e b):
a) la procedura chirurgica sarà minore o maggiore?
[ ] Minore: (ad esempio inserimento di una cannula nei vasi periferici, incisione e sutura dermica, eccetera).
[ ] Maggiore: (ad esempio intervento chirurgico che penetri ed esponga una cavità corporea o abbia il potenziale di produrre un handicap permanente, oppure qualunque procedura che produca un danno permanente delle funzioni fisiche o fisiologiche).
Pag. 74
b) saranno utilizzati interventi chirurgici multipli?
Se SI, giustificare:
2. Nella fase post-operatoria, saranno somministrati agenti antidolorifici?
Se NO, giustificare:
3. Descrivere l'assistenza pre e post-operatoria.
4. Frequenza delle osservazioni nel corso della ripresa dall'anestesia.
5. Criteri utilizzati per valutare il dolore.
SEZIONE 12: EUTANASIA/DESTINAZIONE
LA SEZIONE SEGUENTE DEVE ESSERE COMPLETATA ANCHE SE L'ESITO FINALE DELLA PROCEDURA NON È L'EUTANASIA.
È NECESSARIO INDICARE IL METODO DI EUTANASIA CHE SI INTENDE UTILIZZARE QUALORA SI VERIFICHI UN DETERIORAMENTO IRRISOLVIBILE NELLA SALUTE DEGLI ANIMALI UTILIZZATI NELLA PROCEDURA.
1. Compilare la tabella seguente:
| | | |
|
|
|
|
|
|
| | |
Pag. 75
2. Se l'esito finale della procedura non è l'eutanasia, indicare la destinazione degli animali alla fine del progetto.
SEZIONE 13: ASSISTENZA VETERINARIA
Medico veterinario responsabile del benessere animale
Cognome
Nome
Dipartimento o istituto di afferenza
Indirizzo
Numero di iscrizione all'albo professionale
SEZIONE 14: PERSONALE
| | | |
|
|
|
|
|
|
|
|
|
|
| | |
SEZIONE 15: PARERE DEL COMITATO PER LA CURA E L'UTILIZZO DEGLI ANIMALI.
Il parere del Comitato deve essere allegato alla presente domanda come documentazione tecnico-scientifica del progetto:
a) FAVOREVOLE( )
b) NEGATIVO( )
c) ASSENTE( )
Nel caso b) specificare le motivazioni
Pag. 76
ASSUNZIONE DI RESPONSABILITÀ
IL RESPONSABILE DEL PROGETTO ASSUME LA RESPONSABILITÀ DI QUANTO DICHIARATO NEL PRESENTE ALLEGATO.
Il responsabile del progetto
Nome
Cognome
Firma
Data, ..........................................................
ALTRI:
(compilazione non obbligatoria)
Medico veterinario responsabile del benessere animale
Nome
Cognome
Firma
Responsabile dello stabilimento utilizzatore
Nome
Cognome
Firma
Responsabile delle procedure
Nome
Cognome
Firma
Data, ..........................................................
In caso di assenza del parere del Comitato la dichiarazione deve essere corredata dalle firme del responsabile dell'esecuzione delle procedure e del veterinario responsabile.
Pag. 77
(articolo 9, comma 3).
Ai fini della presente legge sono identificate le categorie, le mansioni e la formazione specifica richieste per il personale che, a vario titolo e livello, opera negli stabilimenti di allevamento, di fornitura e utilizzatori.
Categoria A
1) Operatore di stabilimento.
2) Tecnico di stabilimento.
1) Operatore di stabilimento.
Mansioni: Pulizia e sanificazione delle attrezzature e degli ambienti e controllo dei parametri ambientali, operazioni di pulizia e cambio delle gabbie, approvvigionamento di acqua e cibo, controllo degli animali all'arrivo.
Formazione: Corso in scienza degli animali da laboratorio di almeno 40 ore presso gli enti di cui al comma 11 dell'articolo 9.
Aggiornamento: Moduli di scienza degli animali da laboratorio.
2) Tecnico di stabilimento.
Mansioni: Controllo degli animali in allevamento e in mantenimento e loro identificazione, mantenimento di colonie anche definite microbiologicamente e geneticamente (sessaggio, svezzamento, accoppiamento), trattamenti profilattici e terapeutici, raccolta e registrazione dei dati, monitoraggio delle macchine ed attrezzature, organizzazione di spedizioni e trasporto di animali, controllo dei materiali da magazzino, stoccaggio e trattamento dei rifiuti.
Formazione: Corso in scienza degli animali da laboratorio di almeno 60 ore presso gli enti di cui al comma 11 dell'articolo 9.
Aggiornamento: Moduli di scienza degli animali da laboratorio.
Categoria B
Tecnico che collabora alla esecuzione delle procedure e delle tecniche, ovvero personale che esegue e/o coadiuva nelle procedure e tecniche, sotto la supervisione del responsabile dell'esecuzione delle procedure e delle tecniche.
Pag. 78
Mansioni: Effettuazione delle procedure e delle tecniche, osservazione, rilevazione e registrazione degli effetti legati alla specifica procedura (rilievi ponderali, clinici, patologici, comportamentali); assistenza durante le necroscopie e prelievo di organi e tessuti; esecuzione di tecniche eutanasiche e anestetiche, sotto la supervisione del medico veterinario.
Formazione: Corso in scienza degli animali da laboratorio di almeno 60 ore presso gli enti di cui al comma 11 dell'articolo 9.
Aggiornamento: Moduli integrativi in base alla specie animale e allo specifico campo di applicazione.
Categoria C
1) Ricercatore responsabile della ideazione e pianificazione del progetto.
2) Ricercatore responsabile dell'esecuzione delle procedure e delle tecniche.
3) Ricercatore che partecipa alla pianificazione ed esecuzione delle procedure e delle tecniche.
1. Ricercatore responsabile della ideazione e pianificazione del progetto.
2. Ricercatore responsabile dell'esecuzione delle procedure e delle tecniche.
Mansioni:
1) Pianificazione e direzione del progetto.
2) Responsabilità dell'esecuzione delle procedure e delle tecniche e stesura del protocollo relativo.
Titoli di studio obbligatori (articolo 9, comma 10): Laurea in medicina e chirurgia, medicina veterinaria, biologia, scienze naturali, farmacia, chimica e tecnologie farmaceutiche, scienze agrarie con indirizzo zootecnico, scienze della produzione animale, psicologia ad indirizzo generale e sperimentale o personale universitario docente ed equiparato nei settori scientifico-disciplinari MED, BIO-05, BIO-06, BIO-07, BIO-08, BIO-09, BIO-10, BIO-11, BIO-12, BIO-13, BIO-14, BIO-15, BIO-16, BIO-17, BIO-18, BIO-19, AGR-17, AGR-18, AGR-19, AGR-20, VET, CHIM-08, CHIM-09, CHIM-10, PSI-02, di cui all'allegato A annesso al decreto del Ministro dell'università e della ricerca scientifica e tecnologica 4 ottobre 2000, pubblicato nel supplemento ordinario alla Gazzetta Ufficiale n. 249 del 24 ottobre 2000.
Formazione: Corso di formazione in scienza degli animali da laboratorio di almeno 80 ore presso gli enti di cui al comma 11 dell'articolo 9, e curriculum vitae attestante il raggiungimento della competenza richiesta.
Pag. 79
Aggiornamento: Moduli integrativi in base alla specie animale e allo specifico campo di ricerca.
3. Ricercatore che partecipa alla pianificazione ed esecuzione delle procedure e delle tecniche.
Mansioni: Collaborazione nella pianificazione del progetto e nella esecuzione delle procedure e delle tecniche.
Titoli di studio obbligatori (articolo 9, comma 10): Diploma universitario ovvero studenti laureandi o dottorandi con tesi sperimentali che prevedono l'utilizzo di animali.
Formazione: Corso in scienza degli animali da laboratorio di almeno 80 ore presso gli enti di cui al comma 11 dell'articolo 9 o corsi universitari di uguale durata integrati nei piani di studio.
Aggiornamento: Moduli integrativi in base alla specie animale e allo specifico campo di ricerca.
Categoria D
1) Responsabile dello stabilimento utilizzatore.
2) Responsabile dello stabilimento di allevamento e/o di fornitura.
3) Medico veterinario responsabile del benessere e dello stato sanitario degli animali.
1. Responsabile dello stabilimento utilizzatore.
Mansioni: Responsabilità della gestione e della organizzazione dello stabilimento in tutti gli aspetti, sia di carattere amministrativo, sia sanitario; verifica del rispetto delle leggi relative alla produzione, al mantenimento e all'uso degli animali da laboratorio; supporto e assistenza ai ricercatori per tutte le problematiche relative alla scienza degli animali da laboratorio; verifica della formazione del personale e promozione dell'aggiornamento.
Titolo di studio di base: Laurea in medicina e chirurgia, medicina veterinaria, biologia, scienze naturali, farmacia, chimica e tecnologie farmaceutiche, scienze agrarie con indirizzo zootecnico, scienze della produzione animale, psicologia ad indirizzo generale e sperimentale o personale universitario docente ed equiparato nei settori scientifico-disciplinari MED, BIO-05, BIO-06, BIO-07, BIO-08, BIO-09, BIO-10, BIO-11, BIO-12, BIO-13, BIO-14, BIO-15, BIO-16, BIO-17, BIO-18, BIO-19, AGR-17, AGR-18, AGR-19, AGR-20, VET, CHIM-08, CHIM-09, CHIM-10, PSI-02, di cui all'allegato A annesso al citato decreto del Ministro dell'università e della ricerca scientifica e tecnologica 4 ottobre 2000, pubblicato nel supplemento ordinario alla Gazzetta Ufficiale n. 249 del 24 ottobre 2000.
Pag. 80
Formazione: Corso di specializzazione in scienza degli animali da laboratorio a livello accademico o master o corsi di equivalenti contenuti e durata presso gli enti di cui al comma 11 dell'articolo 9.
Aggiornamento: Moduli integrativi in base alla specie animale e alle procedure impiegate nel progetto.
2. Responsabile dello stabilimento di allevamento e/o di fornitura.
Mansioni: Responsabilità della gestione e della organizzazione dello stabilimento in tutti gli aspetti, sia di carattere amministrativo, sia sanitario; verifica del rispetto delle leggi relative alla produzione e al mantenimento; attestazione della formazione del personale e promozione dell'aggiornamento.
Formazione: Corso in scienza degli animali da laboratorio di almeno 80 ore presso gli enti di cui al comma 11 dell'articolo 9.
3. Medico veterinario responsabile del benessere e dello stato sanitario degli animali.
Mansioni: Controllo del benessere e dello stato di salute degli animali; verifica della corretta esecuzione delle procedure e delle tecniche; prescrizione dei trattamenti profilattici, terapeutici, analgesici necessari; prescrizione, al termine della procedura, della soppressione dell'animale sofferente e scelta del metodo eutanasico più indicato o indicazione della possibilità di affidamento.
Titolo di studio di base: Laurea in medicina veterinaria.
Formazione: Corso di specializzazione in scienza e medicina degli animali da laboratorio a livello accademico o master o corsi di equivalenti contenuti e durata presso gli enti di cui al comma 11 dell'articolo 9.
Aggiornamento: Moduli integrativi in base alla specie animale e alle procedure impiegate nel progetto.
Mansioni: Funzioni di controllo e vigilanza sul mantenimento e uso degli animali utilizzati per fini scientifici o tecnologici.
Titolo di studio di base: Laurea in medicina veterinaria.
Formazione: Corso di specializzazione in scienza e medicina degli animali da laboratorio a livello accademico o master o corsi di equivalenti contenuti e durata presso gli enti di cui al comma 11 dell'articolo 9.
Pag. 81
ALLEGATO 6
(articolo 19, comma 1)
Tabella 1: Animali utilizzati in relazione alla provenienza (Origine rispetto alla specie).
| 1.1
Specie | 1.2
Totale | 1.3
Animali provenienti da stabilimenti di allevamento o da stabilimenti fornitori registrati nel Paese che compila la statistica | 1.4
Animali provenienti da altre fonti nella CE | 1.5
Animali provenienti da Paesi membri del Consiglio d'Europa aderenti Convenzione ETS 123 (Stati membri dell'Unione europea esclusi) | 1.6
Animali provenienti da altre fonti | 1.7
Animali riutilizzati |
| 1.a. Topi (Mus musculus) | ||||||
| 1.b. Ratti (Rattus norvegicus) | ||||||
| 1.c. Porcellini d'India (Cavia porcellus) | ||||||
| 1.d. Criceti (Mesocricetus) | ||||||
| 1.e. Altri roditori (altri Rodentia) | ||||||
| 1.f. Conigli (Oryctolagus cuniculus) | ||||||
| 1.g. Gatti (Felis catus) | ||||||
| 1.n. Cani (Canis familiaris) | ||||||
| 1.i. Furetti (Mustela putorius furo) | ||||||
| 1.j. Altri carnivori (altri Carnivora) | ||||||
| 1.k. Cavalli, asini e incroci (Equidae) | ||||||
| 1.l. Suini (Sus) | ||||||
| 1.m. Caprini (Capra) | ||||||
| 1.n. Ovini (Ovis) | ||||||
| 1.o. Bovini (Bos) | ||||||
| 1.p. Proscimmie (Prosimia) | ||||||
| 1.q. Scimmie del Nuovo mondo (Ceboidea) | ||||||
| 1.r. Scimmie del Vecchio mondo (Cercopithecoidea) | ||||||
| 1.s. Altre scimmie (Hominoidea) | ||||||
| 1.t. Altri mammiferi (altri Mammalia) | ||||||
| 1.u. Quaglie (Coturnix coturnix) | ||||||
| 1.v. Altri uccelli (altri Aves) | ||||||
| 1.w. Rettili (Reptilia) | ||||||
| 1.x. Anfibi (Amphibia) | ||||||
| 1.y. Pesci (Pisces) | ||||||
| 1.z. TOTALE |
Nota 1: La colonia 1.5 riguarda solo gli Stati membri del Consiglio d'Europa che, all'inizio del periodo considerato, aderivano alla Convenzione ETS 123.
Nel compilare questa colonna occorre pertanto utilizzare un elenco aggiornato di tali Paesi.
Nota 2: Compilare solo le caselle a sfondo bianco.
Nota 3: Non deve essere conteggiato nel totale il numero degli animali riutilizzati riportato alla colonna 1.7.
Pag. 82
Tabella 2: Animali utilizzati in esperimenti per fini selezionati (Fini rispetto alla specie).
| 2.1
Specie | 2.2
Studi biologici di base | 2.3
Ricerca e sviluppo di prodotti ed apparecchi per medicina umana, odontoiatria e medicina veterinaria (escluse le prove tossicologiche e di innocuità di cui alla colonna 2.6) | 2.4
Produzione e controllo di qualità di prodotti ed apparecchi per medicina umana ed odontoiatria | 2.5
Ricerca e sviluppo di prodotti ed apparecchi per medicina veterinaria | 2.6
Studi tossicologici e prove di innocuità (anche prodotti ed apparecchi per medicina uma- na, odontoiatria e medicina veterinaria) | 2.7
Diagnosi delle malattie | 2.8
Istruzione delle malattie | 2.9
Altri fini | 2.10
Totale |
| 2.a. Topi | |||||||||
| 2.b. Ratti | |||||||||
| 2.c. Porcellini d'India | |||||||||
| 2.d. Criceti | |||||||||
| 2.e. Altri roditori | |||||||||
| 2.f. Conigli | |||||||||
| 2.g. Gatti | |||||||||
| 2.h. Cani | |||||||||
| 2.i. Furetti | |||||||||
| 2.j. Altri carnivori | |||||||||
| 2.k. Cavalli, asini e incroci | |||||||||
| 2.l. Suini | |||||||||
| 2.m. Caprini | |||||||||
| 2.n. Ovini | |||||||||
| 2.o. Bovini | |||||||||
| 2.p. Proscimmie | |||||||||
| 2.q. Scimmie del Nuovo mondo | |||||||||
| 2.r. Scimmie del Vecchio mondo | |||||||||
| 2.s. Altre scimmie | |||||||||
| 2.t. Altri mammiferi | |||||||||
| 2.u. Quaglie | |||||||||
| 2.v. Altri uccelli | |||||||||
| 2.w. Rettili | |||||||||
| 2.x. Anfibi | |||||||||
| 2.y. Pesci | |||||||||
| 2.z. TOTALE |
Pag. 83
Tabella 3: Animali utilizzati per studi tossicologici e prove di innocuità (Prodotti rispetto alla specie).
| 3.1
Specie | 3.2
Prodotti/sostanze o apparecchi per medicina umana, odontoiatria e medicina veterinaria | 3.3
Prodotti/sostanze utilizzati o destinati ad essere utilizzati principalmente in agricoltura | 3.4
Prodotti/sostanze utilizzati o destinati ad essere utilizzati principalmente nell'industria | 3.5
Prodotti/sostanze utilizzati o destinati principalmente all'uso domestico | 3.6
Prodotti/sostanze utilizzati o destinati ad essere utilizzati principalmente nei cosmetici o nei prodotti per l'igiene personale | 3.7
Prodotti/sostanze utilizzati o destinati ad essere utilizzati principalmente come additivi alimentari per consumo umano | 3.8
Prodotti/sostanze utilizzati o destinati ad essere utilizzati principalmente come alimentari per consumo umano | 3.9
Contaminanti potenziali o reali dell'ambiente in generale (non contemplati in altre colonne) | 3.10
Altri studi tossicologici e prove di innocuità | 3.11
Totale |
| 3.a. Topi | ||||||||||
| 3.b. Ratti | ||||||||||
| 3.c. Porcellini
d'India | ||||||||||
| 3.d. Criceti | ||||||||||
| 3.e. Altri roditori | ||||||||||
| 3.f. Conigli | ||||||||||
| 3.g. Gatti | ||||||||||
| 3.h. Cani | ||||||||||
| 3.i. Furetti | ||||||||||
| 3.j. Altri carnivori | ||||||||||
| 3.k. Cavalli, asini e incroci | ||||||||||
| 3.l. Suini | ||||||||||
| 3.m. Caprini | ||||||||||
| 3.n. Ovini | ||||||||||
| 3.o. Bovini | ||||||||||
| 3.p. Proscimmie | ||||||||||
| 3.q. Scimmie del
Nuovo mondo | ||||||||||
| 3.r. Scimmie del
Vecchio mondo | ||||||||||
| 3.s. Altre scimmie | ||||||||||
| 3.t. Altri mammiferi | ||||||||||
| 3.u. Quaglie | ||||||||||
| 3.v. Altri uccelli | ||||||||||
| 3.w. Rettili | ||||||||||
| 3.x. Anfibi | ||||||||||
| 3.y. Pesci | ||||||||||
| 3.z. TOTALE |
Pag. 84
Tabella 4: Animali utilizzati in esperimenti per lo studio di malattie umane e animali (Categorie principali rispetto alla specie).
| 4.1
Specie | 4.2
Malattie cardiovascolari umane | 4.3
Disturbi nervosi e mentali umani | 4.4
Cancro nell'uomo (escluso lo studio dei rischi di carcinogenesi) | 4.5
Altre malattie umane | 4.6
Studi relativi alle malattie animali | 4.7
Totale |
| 4.a. Topi | ||||||
| 4.b. Ratti | ||||||
| 4.c. Porcellini d'India | ||||||
| 4.d. Criceti | ||||||
| 4.e. Altri roditori | ||||||
| 4.f. Conigli | ||||||
| 4.g. Gatti | ||||||
| 4.h. Cani | ||||||
| 4.i. Furetti | ||||||
| 4.j. Altri carnivori | ||||||
| 4.k. Cavalli, asini e incroci | ||||||
| 4.l. Suini | ||||||
| 4.m. Caprini | ||||||
| 4.n. Ovini | ||||||
| 4.o. Bovini | ||||||
| 4.p. Proscimmie | ||||||
| 4.q. Scimmie del Nuovo mondo | ||||||
| 4.r. Scimmie del Vecchio mondo | ||||||
| 4.s. Altre scimmie | ||||||
| 4.t. Altri mammiferi | ||||||
| 4.u. Quaglie | ||||||
| 4.v. Altri uccelli | ||||||
| 4.w. Rettili | ||||||
| 4.x. Anfibi | ||||||
| 4.y. Pesci | ||||||
| 4.z. TOTALE |
Pag. 85
Tabella 5: Numero di animali utilizzati per la produzione ed il controllo di qualità di prodotti ed apparecchi usati in medicina umana, odontoiatria e medicina veterinaria (Disposizioni legislative rispetto alla specie).
| 5.1
Specie | 5.2
Normative nazionali vigenti in un determinato Stato membro (1) | 5.3
Normative UE e della Farmacopea europea | 5.4
Normative di Paesi membri del Consiglio d'Europa (ma non della CE) (2) | 5.5
Altre normative | 5.6
Qualsiasi combinazione fra 5.2/5.3/5.4/5.5 | 5.7
Nessuna normativa applicabile | 5.8
Totale |
| 5.a. Topi | |||||||
| 5.b. Ratti | |||||||
| 5.c. Porcellini
d'India | |||||||
| 5.d. Criceti | |||||||
| 5.e. Altri roditori | |||||||
| 5.f. Conigli | |||||||
| 5.g. Gatti | |||||||
| 5.h. Cani | |||||||
| 5.i. Furetti | |||||||
| 5.j. Altri carnivori | |||||||
| 5.k. Cavalli, asini e incroci | |||||||
| 5.l. Suini | |||||||
| 5.m. Caprini | |||||||
| 5.n. Ovini | |||||||
| 5.o. Bovini | |||||||
| 5.p. Proscimmie | |||||||
| 5.q. Scimmie del
Nuovo mondo | |||||||
| 5.r. Scimmie del
Vecchio mondo | |||||||
| 5.s. Altre scimmie | |||||||
| 5.t. Altri mammiferi | |||||||
| 5.u. Quaglie | |||||||
| 5.v. Altri uccelli | |||||||
| 5.w. Rettili | |||||||
| 5.x. Anfibi |
Pag. 86
| 5.1
Specie | 5.2
Normative nazionali vigenti in un determinato Stato membro (1) | 5.3
Normative UE e della Farmacopea europea | 5.4
Normative di Paesi membri del Consiglio d'Europa (ma non della CE) (2) | 5.5
Altre normative | 5.6
Qualsiasi combinazione fra 5.2/5.3/5.4/5.5 | 5.7
Nessuna normativa applicabile | 5.8
Totale |
| 5.y. Pesci | |||||||
| 5.z. TOTALE |
Esempi: 5.2 - La Francia segue determinate disposizioni del Regno Unito (o francesi)
Nota: Le colonne da 5.2 a 5.5 fanno riferimento alla normativa che impone lo svolgimento dei test e non all'organismo che decide metodo, direttrici o protocollo dei test.
Note a piè pagina:
5.3 - Il Regno Unito segue la normativa UE
5.4 - La Spagna segue una disposizione ungherese
5.5 - La Svezia segue una determinata disposizione statunitense
5.6 - La Germania segue una disposizione CECA (ed una disposizione CE)
Esempio: un test imposto dalla normativa francese ed effettuato in Belgio secondo un protocollo ISO deve essere riportato dal Belgio come disposizione legislativa nazionale francese ed inserirlo nella colonna 5.2.
1) Stati membri della CE: Austria, Belgio, Cipro, Danimarca, Repubblica Ceca, Estonia, Finlandia, Francia, Germania, Grecia, Ungheria, Irlanda, Italia, Lettonia, Lituania, Lussemburgo, Malta, Paesi Bassi, Polonia, Portogallo, Slovacchia, Slovenia, Regno Unito, Spagna, Svezia, Ungheria.
2) Stati membri del Consiglio d'Europa (non CE): Albania, Andorra, Bulgaria, Croazia, «Ex Repubblica Iugoslava di Macedonia», Islanda, Lettonia, Linchtenstein, Moldova, Norvegia, Romania, Russia, San Marino, Svizzera, Turchia, Ukraina.
Pag. 87
Tabella 6: Animali utilizzati per studi tossicologici e prove di innocuità (Disposizioni legislative rispetto alla specie).
| 6.1
Specie | 6.2
Normative nazionali vigenti in un determinato Stato membro (1) | 6.3
Normative UE e della Farmacopea europea | 6.4
Normative di Paesi membri del Consiglio d'Europa (ma non della CE) (2) | 6.5
Altre normative | 6.6
Qualsiasi combinazione fra 6.2/6.3/6.4/6.5 | 6.7
Nessuna normativa applicabile | 6.8
Totale |
| 6.a. Topi | |||||||
| 6.b. Ratti | |||||||
| 6.c. Porcellini
d'India | |||||||
| 6.d. Criceti | |||||||
| 6.e. Altri roditori | |||||||
| 6.f. Conigli | |||||||
| 6.g. Gatti | |||||||
| 6.h. Cani | |||||||
| 6.i. Furetti | |||||||
| 6.j. Altri carnivori | |||||||
| 6.k. Cavalli, asini e incroci | |||||||
| 6.l. Suini | |||||||
| 6.m. Caprini | |||||||
| 6.n. Ovini | |||||||
| 6.o. Bovini | |||||||
| 6.p. Proscimmie | |||||||
| 6.q. Scimmie del
Nuovo mondo | |||||||
| 6.r. Scimmie del
Vecchio mondo | |||||||
| 6.s. Altre scimmie | |||||||
| 6.t. Altri mammiferi | |||||||
| 6.u. Quaglie | |||||||
| 6.v. Altri uccelli | |||||||
| 6.w. Rettili | |||||||
| 6.x. Anfibi |
Pag. 88
| 6.1
Specie | 6.2
Normative nazionali vigenti in un determinato Stato membro (1) | 6.3
Normative UE e della Farmacopea europea | 6.4
Normative di Paesi membri del Consiglio d'Europa (ma non della CE) (2) | 6.5
Altre normative | 6.6
Qualsiasi combinazione fra 5.2/5.3/5.4/5.5 | 6.7
Nessuna normativa applicabile | 6.8
Totale |
| 6.y. Pesci | |||||||
| 6.z. TOTALE |
Esempi: 6.2 - La Francia segue determinate disposizioni del Regno Unito (o francesi)
Nota: Le colonne da 6.2 a 6.6 fanno riferimento alla normativa che impone lo svolgimento dei test, e non all'organismo che decide metodo, direttrici o protocollo dei test.
Note a piè pagina:
6.3 - Il Regno Unito segue la normativa UE
6.4 - La Spagna segue una disposizione ungherese
6.5 - La Svezia segue una determinata disposizione statunitense
6.6 - La Germania segue una disposizione CECA (ed una disposizione CE)
Esempio: un test imposto dalla normativa francese ed effettuato in Belgio secondo un protocollo ISO deve essere riportato dal Belgio come disposizione legislativa nazionale francese ed inserirlo nella colonna 6.2.
1) Stati membri della CE: Austria, Belgio, Cipro, Danimarca, Repubblica Ceca, Estonia, Finlandia, Francia, Germania, Grecia, Ungheria, Irlanda, Italia, Lettonia, Lituania, Lussemburgo, Malta, Paesi Bassi, Polonia, Portogallo, Slovacchia, Slovenia, Regno Unito, Spagna, Svezia, Ungheria.
2) Stati membri del Consiglio d'Europa (non CE): Albania, Andorra, Bulgaria, Croazia, «Ex Repubblica Iugoslava di Macedonia», Islanda, Lettonia, Linchtenstein, Moldova, Norvegia, Romania, Russia, San Marino, Svizzera, Turchia, Ukraina.
Pag. 89
Tabella 7: Animali utilizzati per studi tossicologici e prove di innocuità
(Tipi di prove rispetto alla specie).
| 7.1
Specie | 7.2
Metodi di determinazione della tossicità acuta e subacuta (compreso il saggio limite) | 7.3
Irritazione cutanea | 7.4
Sensibilizzazione cutanea | 7.5
Irritazione oculare | 7.6
Tossicità cronica e subcronica | 7.7
Cancerogenicità | 7.8
Tossicità per lo sviluppo | 7.9
Mutagenicità | 7.10
Tossicità sulla riproduzione | 7.11
Tossicità su vertebrati acquatici non contemplati in altre colonne | 7.12
Altri test | 7.13
Totale | ||
| 7.2.1
LD50, LC50 | 7.2.2
Altri metodi letali | 7.2.3
Metodi non letali basati su segni clinici | ||||||||||||
| 7.a. Topi | ||||||||||||||
| 7.b. Ratti | ||||||||||||||
| 7.c. Porcellini d'India | ||||||||||||||
| 7.d. Criceti | ||||||||||||||
| 7.e. Altri roditori | ||||||||||||||
| 7.f. Conigli | ||||||||||||||
| 7.g. Gatti | ||||||||||||||
| 7.h. Cani | ||||||||||||||
| 7.i. Furetti | ||||||||||||||
| 7.j. Altri carnivori | ||||||||||||||
| 7.k. Cavalli, asini e incroci | ||||||||||||||
| 7.l. Suini | ||||||||||||||
| 7.m. Caprini | ||||||||||||||
| 7.n. Ovini | ||||||||||||||
| 7.o. Bovini | ||||||||||||||
| 7.p. Proscimmie | ||||||||||||||
| 7.q. Scimmie del Nuovo mondo | ||||||||||||||
| 7.r. Scimmie del Vecchio mondo | ||||||||||||||
| 7.s. Altre scimmie | ||||||||||||||
| 7.t. Altri mammiferi | ||||||||||||||
| 7.u. Quaglie | ||||||||||||||
| 7.v. Altri uccelli | ||||||||||||||
| 7.w. Rettili | ||||||||||||||
| 7.x. Anfibi | ||||||||||||||
| 7.y. Pesci | ||||||||||||||
| 7.z. TOTALE | ||||||||||||||
Pag. 90
Tabella 8: Animali utilizzati per studi tossicologici e prove di innocuità
(Tipi di prove rispetto al prodotto).
| 8.1
Prodotti | 8.2
Metodi di determinazione della tossicità acuta e subacuta (compreso il saggio limite) | 8.3
Irritazione cutanea | 8.4
Sensibilizzazione cutanea | 8.5
Irritazione oculare | 8.6
Tossicità cronica e subcronica | 8.7
Cancerogenicità | 8.8
Tossicità per lo sviluppo | 8.9
Mutagenicità | 8.10
Tossicità sulla riproduzione | 8.11
Tossicità su vertebrati acquatici non contemplati in altre colonne | 8.12
Altri test | 8.13
Totale | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 8.2.1
LD50, LC50 | 8.2.2
Altri metodi letali | 8.2.3
Metodi non letali basati su segni clinici | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 8.a. odontoiatria e medicina veterinaria
|
|
|
|
|
|
|
|
|
|
|
|
|
| 8.b. | principalmente in agricoltura
|
|
|
|
|
|
|
|
|
|
|
|
|
| 8.c. | principalmente nell'industria
|
|
|
|
|
|
|
|
|
|
|
|
|
| 8.d. | all'uso domestico
|
|
|
|
|
|
|
|
|
|
|
|
|
| 8.e. | principalmente nei cosmetici o nei prodotti per l'igiene personale
|
|
|
|
|
|
|
|
|
|
|
|
|
| 8.f. | principalmente come additivi alimentari per consumo umano
|
|
|
|
|
|
|
|
|
|
|
|
|
| 8.g. | principalmente come additivi alimentari per consumo animale
|
|
|
|
|
|
|
|
|
|
|
|
|
| 8.h. | (non contemplati in altre colonne)
|
|
|
|
|
|
|
|
|
|
|
|
|
| 8.i. Altri studi tossicologici e prove di innocuità
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| 8.j. Totale
|
|
|
|
|
|
|
|
|
|
|
|
|
| | |
|

|